
分析 (1)依据题意可知钠与H2在一定温度下可反应生成一种叫氢化钠,反应中氢元素化合价降低;
(2)氢化钠与水发生归中反应生成氢氧化钠和氢气,氢化钠中-1价的氢化合价升高.
解答 解:(1)据题意可知钠与H2在一定温度下可反应生成一种叫氢化钠,方程式:2Na+H2$\frac{\underline{\;\;△\;\;}}{\;}$2NaH,反应中氢元素化合价降低,氢气为氧化剂;
故答案为:2Na+H2$\frac{\underline{\;\;△\;\;}}{\;}$2NaH; 氧化;
(2)氢化钠与水发生归中反应生成氢氧化钠和氢气,方程式:NaH+H2O═NaOH+H2↑;氢化钠中-1价的氢化合价升高,氢化钠为还原剂;
故答案为:NaH+H2O═NaOH+H2↑;还原.
点评 本题考查了元素化合物知识,氧化还原反应基本概念判断,明确物质的性质及氧化还原反应基本规律是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
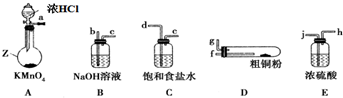

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 用干燥洁净的玻璃棒蘸取待测溶液,滴在pH试纸上,再跟标准比色卡比较得到该溶液的pH值 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO的生成速率与CO2的生成速率相等 | |
| B. | 气体的密度不再变化 | |
| C. | CO的质量不变 | |
| D. | 体系的压强不再发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
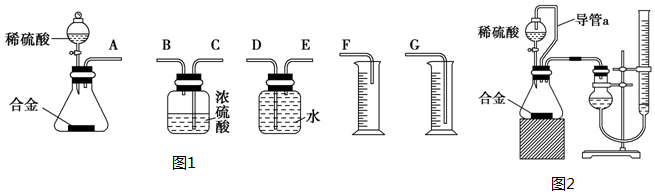
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3NO2+H2O═2HNO3+NO | B. | 4FeS2+11O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8SO2 | ||
| C. | 3Cl2+8NH3═N2+6NH4Cl | D. | 2Na+2NH3(液)═2NaNH2+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
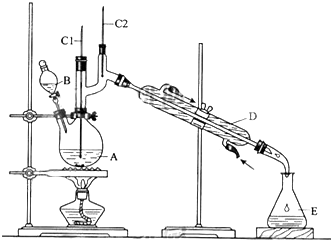
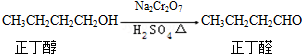
| 沸点/℃ | 密度(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.5 | 0.8107 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com