
【题目】(1)在一定温度下,有下列反应发生:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g),该反应的平衡常数表达式K=________。
(2)在配制FeCl3溶液时,加入少许浓盐酸,其目的是:_____________;不断加热FeCl3溶液,蒸干其水分并灼烧固体,最后得到的物质是________。
(3)已知:Fe2O3(s)+![]() C(s)=
C(s)=![]() CO2(g)+2Fe(s) ΔH=+234.1 kJ/mol
CO2(g)+2Fe(s) ΔH=+234.1 kJ/mol
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
则2Fe(s)+![]() O2(g)===Fe2O3(s)的ΔH是____________________。
O2(g)===Fe2O3(s)的ΔH是____________________。
(4)Fe(OH)2在空气中短时间内可被氧化为Fe(OH)3,发生的反应为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,下列说法中错误的是________(填字母)。
A.该反应是能自发进行的反应
B.该反应是熵增加的反应
C.该反应是化合反应
D.该反应是氧化还原反应
【答案】![]() 抑制Fe3+水解 Fe2O3 -824.35 kJ/mol B
抑制Fe3+水解 Fe2O3 -824.35 kJ/mol B
【解析】
(1)固体、纯液体不计入平衡常数表达式;
(2)FeCl3是强酸弱碱盐,水解呈酸性;加热促进氯化铁水解,氯化铁溶液中铁离子水解生成氢氧化铁和盐酸,蒸发溶液,氯化氢挥发;
(3)根据盖斯定律计算2Fe(s)+![]() O2(g)== Fe2O3(s)的ΔH;
O2(g)== Fe2O3(s)的ΔH;
(4)该反应在常温下易于进行,反应是自发进行的氧化还原反应,该反应是反应前后气体体积减小的化合反应;
(1)平衡常数是各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,固体、纯液体不计入平衡常数表达式,Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g),该反应的平衡常数表达式K=![]() ;
;
(2)铁离子水解Fe3++3H2O![]() Fe(OH)3+3H+,实验室配制FeCl3溶液时,应向其中加入少量浓盐酸抑制铁离子水解;
Fe(OH)3+3H+,实验室配制FeCl3溶液时,应向其中加入少量浓盐酸抑制铁离子水解;
氯化铁溶液中铁离子水解生成氢氧化铁和盐酸,蒸发溶液,氯化氢挥发,得到水解产物氢氧化铁,灼烧得到氧化铁;
(3)①Fe2O3(s)+![]() C(s)=
C(s)=![]() CO2(g)+2Fe(s)ΔH=+234.1 kJ/mol
CO2(g)+2Fe(s)ΔH=+234.1 kJ/mol
②C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
根据盖斯定律,②×![]() - ①得2Fe(s)+
- ①得2Fe(s)+![]() O2(g)===Fe2O3(s) ΔH=-393.5 kJ/mol ×
O2(g)===Fe2O3(s) ΔH=-393.5 kJ/mol ×![]() -234.1 kJ/mol=-824.35 kJ/mol;
-234.1 kJ/mol=-824.35 kJ/mol;
(4)A.Fe(OH)2在空气中短时间内可被氧化为Fe(OH)3,该反应是能自发进行的反应,故A正确;
B.反应后气体体积减小,该反应是熵减小的反应,故B错误;
C.该反应由三种物质生成一种物质,是化合反应,故C正确;
D.反应前后铁元素、氧元素化合价发生变化,该反应是氧化还原反应,故D正确;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大
A.①④B.②③C.①③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟工业生产食品香精菠萝酯(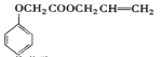 )的简易流程如下:
)的简易流程如下:
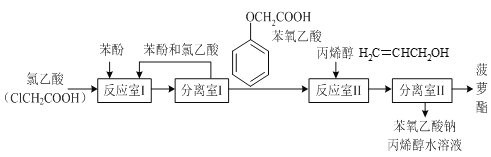
有关物质的熔、沸点如表:
苯酚 | 氯乙酸 | 苯氧乙酸 | |
熔点/℃ | 43 | 62 | 99 |
沸点/℃ | 181.9 | 189 | 285 |
试回答下列问题:
(1)反应室I中反应的最佳温度是104℃,为较好地控制温度在102℃~106℃之间,加热时可选用___(选填字母)。
A.火炉直接加热 B.水浴加热 C.油浴加热
(2)分离室I采取的操作名称是___。
(3)反应室I中发生反应的化学方程式是___。
(4)分离室II的操作为:①用NaHCO3溶液洗涤后分液;②有机层用水洗涤后分液;洗涤时不能用NaOH溶液代替NaHCO3溶液,其原因是___(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是
A. pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5mol·L—1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D. pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K、Ka、KW分别表示化学平衡常数、电离常数和水的离子积常数,下列判断正确的是( )
A.在500 ℃、20 MPa条件下,在5 L密闭容器中进行合成氨的反应,使用催化剂后K增大
B.室温下K(HCN)<K(CH3COOH),说明CH3COOH的电离度一定比HCN的大
C.25 ℃时,pH均为4的盐酸和NH4I溶液中KW不相等
D.2SO2+O2![]() 2SO3达平衡后,改变某一条件时K不变,SO2的转化率可能增大、减小或不变
2SO3达平衡后,改变某一条件时K不变,SO2的转化率可能增大、减小或不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】安全气囊是行车安全的重要设施,当车辆发生碰撞的瞬间,安全装置通电点火使其中的粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客的安全。为研究安全气囊工作的化学原理,取安全装置中的粉末进行研究。经实验分析,确定该粉末是一种混合物且只含Na、Fe、N、O四种元素。
(1)氧元素在元素周期表中的位置是__________,Na原子的结构示意图为__________,Na、Fe、N、O四种元素中三种主族元素的离子半径从大到小的顺序是__________(用离子符号表示)。
(2)水溶性实验表明,安全装置中固体粉末部分溶解。不溶物为一种红棕色固体,可溶于盐酸。已知该不溶物能发生铝热反应,写出该反应的化学方程式:___________。
(3)氮的最高价氧化物对应的水化物与其氢化物反应生成一种盐,该盐中含有的化学键类型是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中进行反应:X2(g)+3Y2(g) ![]() 2Z2(g),若X2、Y2、Z2的初始物质的量浓度分别为0.10mol·L-1、0.30mol·L-1、0.20mol·L-1,当反应达到平衡时Z2的物质的量浓度不可能是
2Z2(g),若X2、Y2、Z2的初始物质的量浓度分别为0.10mol·L-1、0.30mol·L-1、0.20mol·L-1,当反应达到平衡时Z2的物质的量浓度不可能是
A. 0.05mol·L-1 B. 0.20mol·L-1 C. 0.35mol·L-1 D. 0.40mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.向0.1molL-1的CH3COOH溶液中加入少量碳酸钙固体,溶液的pH增大
B.室温下,pH=4的NaHSO4溶液中,水电离出的H+浓度为1×10-10molL-1
C.浓度均为0.1molL-1的HCN溶液和NaCN溶液等体积混合(忽略体积变化),溶液中c(HCN)+c(CN-)=0.1molL-1
D.pH相同的①NH4Cl、②NH4Al(SO4)2、③(NH4)2SO4三种溶液的c(NH4+):②<③<①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家对CO2的应用研究日新月异。
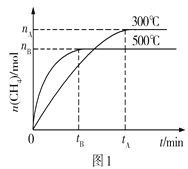
(1)科学家研制成功一种新型催化剂,能将CO2转变为甲烷。在常压、300℃,CO2与H2体积比为1︰4时在体积为V L的容器中反应,CO2转化率达90%。由图1可知升高温度,K将___(填“增大”“减小”或“不变”);300℃时,从反应开始,到达到平衡,以H2的浓度变化表示化学反应速率是____(用nA、tA、V表示)。
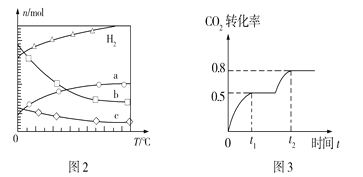
(2)CO2经催化加氢还可合成低碳烯烃有机物:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH=Q kJ·mol1。在0.1MPa时,按n(CO2)︰n(H2)=1︰3投料,图2表示平衡时四种气态物质的物质的量(n)与温度(T)的关系。
C2H4(g)+4H2O(g) ΔH=Q kJ·mol1。在0.1MPa时,按n(CO2)︰n(H2)=1︰3投料,图2表示平衡时四种气态物质的物质的量(n)与温度(T)的关系。
①Q___0(填“>”“=”或“<”);
②曲线c表示的物质为____;
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是___。
(3)已知CO2(g)+2CH3OH(g)![]() CH3OCOOCH3(g)+H2O(g)。在恒温容积可变的容器中加入1mol CO2、2mol CH3OH,CO2的转化率与反应时间如图3所示,在反应过程中加压,若t1时容器体积为1000mL,则t2时容器体积为_____mL。
CH3OCOOCH3(g)+H2O(g)。在恒温容积可变的容器中加入1mol CO2、2mol CH3OH,CO2的转化率与反应时间如图3所示,在反应过程中加压,若t1时容器体积为1000mL,则t2时容器体积为_____mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com