
| A. | 一氯甲烷(CH3Cl) | B. | 甲基(-CH3 ) | C. | 碳负离子(CH3-) | D. | 乙烯(C2H4) |
分析 碳原子最外层电子数为4+共用电子对数+获得电子数(或减去失去电子数),据此计算.
解答 解:A.一氯甲烷(CH3Cl)中C原子形成4个共用电子对,碳原子最外层电子数为4+4=8,满足最外层为8电子结构,故A不选;
B.甲基(-CH3 )中C原子形成3个共用电子对,则碳原子最外层电子数为4+3=7,不满足最外层为8电子结构,故B选;
C.碳负离子(CH3-)中碳原子与另三个碳原子形成3对共用电子对,且中心碳原子得到一个电子,最外层电子数为4+3+1=8,满足最外层为8电子结构,故C不选;
D.乙烯(C2H4)中C原子形成4个共用电子对,则碳原子最外层电子数为4+4=8,满足最外层为8电子结构,故D不选.
故选B.
点评 本题考查8电子结构,难度不大,清楚各微粒结构是解题的关键,注意碳原子最外层电子数为4+共用电子对数+获得电子数(或减去失去电子数).


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,CO2的结构式为O=C=O.
,CO2的结构式为O=C=O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| B. | 稀 H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀H2SO4 反应:Ba2++SO42-=BaSO4↓ | |
| D. | 氯化铜溶液与铁粉反应:Cu2++Fe=Fe2++Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,纵坐标表示导电能力,横坐标表示所加溶液的量,以下各组反应,符合该图的是( )
如图所示,纵坐标表示导电能力,横坐标表示所加溶液的量,以下各组反应,符合该图的是( )| A. | 氨水中滴加与其浓度相同的盐酸 | |
| B. | NaOH溶液中滴加与其浓度相同的稀盐酸 | |
| C. | CH3COOH溶液中滴加与其浓度相同的KOH溶液 | |
| D. | Ba(OH)2溶液中滴加与其浓度相同的H2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0的溶液中:Fe2+、Na+、Cl-、NO3- | |
| B. | 无色溶液中:Ba2+、Zn2+、Cl-、NO3- | |
| C. | 加入铝粉后能产生气体的溶液中:Mg2+、Ba2+、SO32-、NO3- | |
| D. | 常温下水电离出的c(H+)=10-12的溶液中:Fe3+、K+、ClO-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3溶液的浓度减小 | B. | 阳极上产生O2 | ||
| C. | 转移的电子数为0.02NA个 | D. | 阴极发生了氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
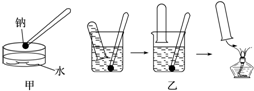 金属钠与水的反应是中学化学中的一个重要反应.该反应的演示方法分别如图甲、乙所示:
金属钠与水的反应是中学化学中的一个重要反应.该反应的演示方法分别如图甲、乙所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com