
| A. | 24克金刚石中含有的碳碳键数目为4NA | |
| B. | 50mL18.4mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| C. | 1L1mol•L-1饱和FeCl3溶液滴入沸水中完全水解生成Fe(OH)3胶体粒子数为NA | |
| D. | 120克熔融的NaHSO4中含有的离子数为3NA |
分析 A、求出金刚石的物质的量,然后根据1mol金刚石中含2mol碳碳键来分析;
B、铜只能与浓硫酸反应,与稀硫酸不反应;
C、一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
D、熔融的NaHSO4只能电离出钠离子和硫酸氢根离子.
解答 解:A、24g金刚石的物质的量为2mol,而1mol金刚石中含2mol碳碳键,故2mol金刚石中含4NA条碳碳键,故A正确;
B、铜只能与浓硫酸反应,与稀硫酸不反应,故浓硫酸变稀后反应即停止,即硫酸不能反应完全,生成的二氧化硫分子小于0.46NA个,故B错误;
C、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故生成的胶粒的个数小于NA个,故C错误;
D、120g熔融的NaHSO4的物质的量为1mol,而在熔融状态下,其只能电离出钠离子和硫酸氢根离子,故1mol熔融的NaHSO4含有的离子为2NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | H2SO4的摩尔质量为98g | |
| B. | 1molH2SO4的质量为98g/mol | |
| C. | 标准状况下2molO2的体积约为44.8L | |
| D. | 室温常压下气体摩尔体积约为22.4L/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
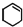 )为原料合成,路线如下(部分反应条件省略):
)为原料合成,路线如下(部分反应条件省略):
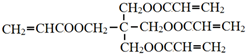
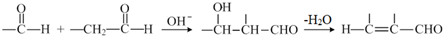

 的化学方程式是
的化学方程式是 .
.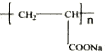
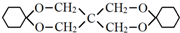 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心就是治理工业生产对环境产生的污染 | |
| B. | 铁、钙、碘都是人体必不可少的微量元素 | |
| C. | 食盐可作调味剂,但不可作食品防腐剂 | |
| D. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

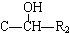 (R代表烃基或氢原子,下同.)
(R代表烃基或氢原子,下同.)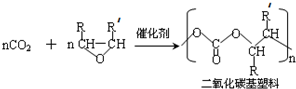
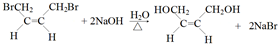 ,反应④的化学反应方程式
,反应④的化学反应方程式 ,反应⑤的化学反应方程式
,反应⑤的化学反应方程式
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素H只有${\;}_1^1$H和${\;}_1^2$H两种核素 | |
| B. | Cl2、NH4Cl中氯元素微粒的半径:r(Cl)>r(Cl-) | |
| C. | 工业上常用干燥的钢瓶储存液氯,是因为铁和氯气在任何条件下都不反应 | |
| D. | 该反应表明常温下氯气有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com