
已知33As、35Br位于同一周期,下列关系正确的是
| A.原子半径:As>C1>P | B.热稳定性:HC1>AsH3>HBr |
| C.还原性:As3->S2->C1- | D.酸性:H3AsO4>H2SO4>H3PO4 |
 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:单选题
下列实验操作与实验目的相符的是( )
| 序号 | 实验操作 | 实验目的 |
| A | 测定HF、HCl的熔点、沸点 | 比较F、Cl的非金属性强弱 |
| B | MgSO4、Al2(SO4)3溶液中分别滴加足量氨水 | 比较镁、铝的金属性强弱 |
| C | 将SO2气体通入碳酸钠溶液中 | 比较碳、硫的非金属性强弱 |
| D | 向氯化铵、氯化铝混合溶液中,滴加氢氧化钠溶液至过量 | 比较NaOH、NH3·H2O、Al(OH)3的碱性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如图所示。Z元素原子核外K层与M层电子数相等。下列说法中正确的是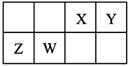
| A.Y元素最高价氧化物对应的水化物化学式为H2YO3 |
| B.原子半径由小到大的顺序为:Y<X<W<Z |
| C.室温下,Z和W的单质均能溶于浓硝酸 |
| D.X、Z两种元素的氧化物中所含化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
周期表中,前20号元素内X、Y元素的离子符号是xm+、yn-,他们的核外电子排布相同,据此可推得:
(1)元素X和 Y所属周期的周期数之差为
(2)元素X和Y的核电荷数之差为(用含m、n的代数式表示)
(3)Xm+、yn-的离子半径由大到小的顺序是
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是( )
| A.若X+和Y2-的核外电子层结构相同,则原子序数:X>Y |
| B.由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S |
| C.在元素周期表中,硅、锗都位于金属与非金属的交界处,都可以作半导体材料 |
| D.Cs和Ba分别位于第六周期ⅠA族和ⅡA族,碱性:CsOH>Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | 啤酒和饮料中常溶有X的最高价氧化物,打开瓶子时,这种氧化物会大量逸出 |
| Y | Y2是空气中含量最高的气体单质 |
| Z | Z的基态原子最外层电子排布式为2s22p4 |
| W | W的一种核素质量数为27,中子数为14 |
 Y2O4(g) △H2=-56.9kJ/mol
Y2O4(g) △H2=-56.9kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:单选题
X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子最外层电子数之和与Ca2+的核外电子数相等,Y、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构。下列说法正确的是
| A.原子半径:Z>Y>X | B.Z与X在同一周期 |
| C.氢化物的稳定性:X>Y | D.XZ4属于共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
X、Y、Z均为短周期元素,其简单离子X+、Y3+、Z2- 的核外电子层结构相同。下列说法不正确的是
| A.原子序数:Y > X > Z |
| B.碱性:XOH > Y(OH)3 |
| C.单质的还原性:X > Y |
| D.离子半径:X+ > Y3+ > Z2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com