


科目:高中化学 来源: 题型:
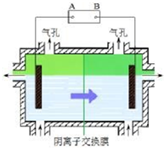 某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等.已知碳酸锰难溶于水.一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如下:
某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等.已知碳酸锰难溶于水.一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如下: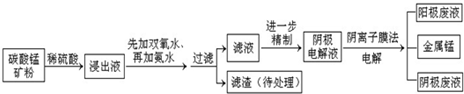
| 离子 | Fe3+ | Al3+ | Fe2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 | 9.3 |
| 沉淀完全的pH | 3.7 | 4.7 | 9.6 | 9.8 | 10.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
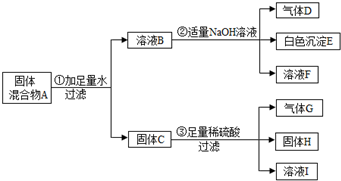
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuCl2 |
| B、FeCl3 |
| C、AlCl3 |
| D、FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(A)=0.8mol/(L?S) |
| B、v(B)=0.3mol/(L?S) |
| C、v(C)=0.5mol/(L?S) |
| D、v(D)=60mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
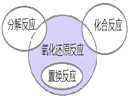
| A、4NH3+5O2═4NO+6H2O |
| B、4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
| C、2NaHCO3═Na2CO3+H2O+CO2↑ |
| D、Cl2+2NaBr═2NaCl+Br2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com