
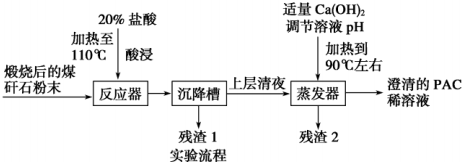
分析 煤矸石(主要含Al2O3、SiO2及Fe2O3)中加入稀盐酸并加热,发生的反应为Al2O3+6HCl=2AlCl3+3H2O、Fe2O3+6HCl=2FeCl3+3H2O,SiO2不溶于稀盐酸,然后过滤得到的滤渣1中成分为SiO2,滤液中溶质为AlCl3、FeCl3,向滤液中加入适量氢氧化钙溶液并加热,得到氢氧化铁沉淀,过滤得到滤渣2为Fe(OH)3,滤液中成分为{[Al2(OH)nCl16-n]m、CaCl2,
(1)浓盐酸配20%的盐酸用到的仪器有:量筒、烧杯、玻璃棒;
(2)氧化铝 属于两性氧化物,氧化铁属于碱性氧化物,均能和强酸之间反应生成对应的盐和水;
(3)氢氧化铝可以溶于强碱溶液中,但是氢氧化铁和氢氧化钠之间不反应,据此来回答判断滤渣成分;可以采用硫氰化钾检验三价铁的存在;
(4)蒸发浓缩,冷却结晶可以将溶液中的氯化铝和转化为晶体,根据流程来回答的离子;
(5)从不引入杂质角度去考虑,根据选项判断能选择的试剂.
解答 解:煤矸石(主要含Al2O3、SiO2及Fe2O3)中加入稀盐酸并加热,发生的反应为Al2O3+6HCl=2AlCl3+3H2O、Fe2O3+6HCl=2FeCl3+3H2O,SiO2不溶于稀盐酸,然后过滤得到的滤渣1中成分为SiO2,滤液中溶质为AlCl3、FeCl3,向滤液中加入适量氢氧化钙溶液并加热,得到氢氧化铁沉淀,过滤得到滤渣2为Fe(OH)3,滤液中成分为{[Al2(OH)nCl16-n]m、CaCl2,
(1)浓盐酸配20%的盐酸用到的仪器有:量筒、烧杯、玻璃棒,故答案为:量筒、烧杯、玻璃棒;
(2)氧化铝 氧化铁属于碱性氧化物,均能和强酸之间反应生成对应的盐和水,反应的方程式为Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O,
故答案为:Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O;
(3)氢氧化铝可以溶于强碱溶液中,但是氢氧化铁和氢氧化钠之间不反应,所以滤渣2是氢氧化铁,他可以和强酸之间反应得到三价铁盐,可以采用硫氰化钾检验三价铁的存在,
故答案为:Fe(OH)3;取少量残渣2于小试管中,加入稀盐酸使其完全溶解,再加入KSCN溶液,溶液呈(血)红色;
(4)从澄清的PAC稀溶液获得聚合氯化铝固体,可以采用蒸发浓缩,冷却结晶的方法,加入氢氧化钙调节溶液的pH过程中,引进的钙离子会混入PAC粗产品中,故答案为:蒸发浓缩,冷却结晶;Ca2+;
(5)从不引入杂质角度去考虑,加入NaOH和氨水会引入钠离子和铵根离子,故选BD.
点评 本题考查物质分离和提纯,为高频考点,侧重于学生的分析、实验能力的考查,涉及基本操作、仪器选取等知识点,明确实验原理是解本题关键,知道流程图中发生的反应及基本操作,题目难度中等.


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:多选题
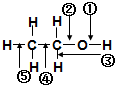
| A. | 和金属钠作用时,键②断裂 | |
| B. | 和浓硫酸共热至170℃时,键②和⑤断裂 | |
| C. | 和HBr共热时,键④断裂 | |
| D. | 在铜催化下和氧气反应时,键①和③断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
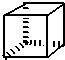 “立方烷”是新合成的一种烃,其分子为正立方体结构,其结构如图所示:
“立方烷”是新合成的一种烃,其分子为正立方体结构,其结构如图所示: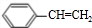 ;这种芳香烃异构体与单体ACH2=C(CH3)CC(CH3)=CH2(写结构简式)可合成具有
;这种芳香烃异构体与单体ACH2=C(CH3)CC(CH3)=CH2(写结构简式)可合成具有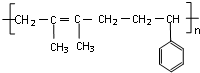
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L的Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S) | |
| B. | 0.1 mol/L的Na2CO3溶液中:c(Na+ )+2[c(CO3 2-)+c(HCO3-)+c(H2CO3)] | |
| C. | 浓度均为0.1mol•L-1 的碳酸钠溶液和氨水溶液中,由水电离的出的 c(OH-):前者大于后者 | |
| D. | 浓度为0.1 mol/L NH4Cl和0.1mol/L NH3•H2O等体积混合溶液中pH>7,则:c(NH4+ )>c(Cl-)>c(OH-)>c(NH3•H2O)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测0.1mol•L-1氨水的pH为11:NH3•H2O?NH${\;}_{4}^{+}$+OH- | |
| B. | 将Na块放入水中,放出气体:2Na+2H2O=2NaOH+H2↑ | |
| C. | 铝片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O=2AlO${\;}_{2}^{-}$+3H2↑ | |
| D. | 用CuCl2溶液做导电实验,灯泡发光:CuCl2$\frac{\underline{\;电解\;}}{\;}$Cu2++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅤⅠA | ⅤⅡA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | J | K | ||
| 4 | L | M |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
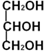 )与足量丙酸(CH3CH2COOH)发生酯化的反应方程式:
)与足量丙酸(CH3CH2COOH)发生酯化的反应方程式: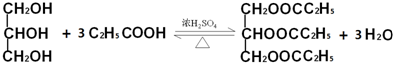
 若有气泡产生(且产生的气体可燃)则其结构为CH3CH2OH;如无明显现象,则为CH3OCH3.
若有气泡产生(且产生的气体可燃)则其结构为CH3CH2OH;如无明显现象,则为CH3OCH3.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
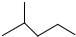 表示的分子式结构简式名称是C6H14、(CH3)2CHCH2CH2CH3、2-甲基戊烷.
表示的分子式结构简式名称是C6H14、(CH3)2CHCH2CH2CH3、2-甲基戊烷.| 实验步骤 | 解释或实验结论 |
| (1)称取A物质 18.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空: ?A的相对分子质量为:90 |
(2)A的核磁共振氢谱如图: | ?A中含有4种氢原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com