
| A. | KOH | B. | H2SO4 | C. | HClO4 | D. | MgSO4 |
分析 酸或碱、强酸酸式盐抑制水电离,含有弱离子的盐促进水电离,常温下,某溶液中由水电离产生的c(H+)=1×10-10mol/L<1×10-7mol/L,说明水的电离受到抑制,则溶液中的溶质为酸、碱或强酸酸式盐,据此分析解答.
解答 解:酸或碱、强酸酸式盐抑制水电离,含有弱离子的盐促进水电离,常温下,某溶液中由水电离产生的c(H+)=1×10-10mol/L<1×10-7mol/L,说明水的电离受到抑制,则溶液中的溶质为酸、碱或强酸酸式盐,
A.KOH是强碱,KOH电离出氢氧根离子而抑制水电离,故A不选;
B.硫酸是强酸,硫酸电离出氢离子而抑制水电离,故B不选;
C.高氯酸是强酸,高氯酸电离出氢离子而抑制水电离,故C不选;
D.硫酸镁是强酸弱碱盐,镁离子水解而促进水电离,故D选;
故选D.
点评 本题考查水的电离,会根据水的电离程度确定溶液中的溶质是解本题关键,知道哪些物质促进水电离、哪些物质抑制水电离,注意强酸酸式盐抑制水电离、强酸强碱盐不影响水电离.


科目:高中化学 来源: 题型:解答题
 将一定质量的Mg-Al合金投入到100mL一定物质的量浓度的HCl中,合金全部溶解,向所得溶液中滴加5mol/LNaOH溶液至过量,生成沉淀质量与加入NaOH溶液的体积关系如下图所示.
将一定质量的Mg-Al合金投入到100mL一定物质的量浓度的HCl中,合金全部溶解,向所得溶液中滴加5mol/LNaOH溶液至过量,生成沉淀质量与加入NaOH溶液的体积关系如下图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 34S原子核内中子数为16 | |
| B. | 1H${\;}_{2}^{16}$O和1H${\;}_{2}^{18}$O的相对分子质量不同 | |
| C. | 13C和15N原子的原子序数相差2 | |
| D. | 2H+结合OH-的能力比1H+的更强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若XY3分子中X原子处于正三角形的中心,则XY3分子为非极性分子 | |
| B. | C2H5OH与C2H5Br相比,前者的沸点远高于后者,其原因是前者的分子间存在氢键 | |
| C. | 同周期ⅠA族元素和ⅦA族元素之间只能形成离子化合物 | |
| D. | 由两种非金属元素组成的化合物分子中只可能有极性键,不会有非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

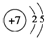 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{88}^{226}$Ra原子核内有138个中子 | B. | ${\;}_{88}^{226}$Ra原子核外有88个电子 | ||
| C. | ${\;}_{88}^{226}$Ra原子核内有88个质子 | D. | Ra元素位于第六周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 编号 | 元素原子结构 |
| X | 原子结构示意图为 |
| Y | 最外层电子数是次外层电子数的2倍 |
| Z | 原子核内含有12个中子,且其离子的结构示意图为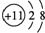 |
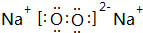 ,用电子式表示X的气态氢化物的形成过程
,用电子式表示X的气态氢化物的形成过程 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属都可以保存在煤油中 | |
| B. | 碱金属元素的单质硬度小、密度小、熔点低 | |
| C. | 在空气中加热均可生成多种氧化物 | |
| D. | 碱金属与水反应,均漂浮在水面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,同体积的气体A、B质量比m:n | |
| B. | 25℃时,1Kg气体A与1Kg气体B的分子数之比为n:m | |
| C. | 同温同压下,气体A与气体B的密度之比为n:m | |
| D. | 标准状况下,等质量的A与B的体积比为n:m |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com