
| A. | ①②③ | B. | ①②③⑥ | C. | ②③⑥ | D. | ②⑥ |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
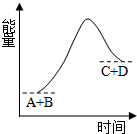
| A. | 形成C、D键释放的总能量大于断A、B键吸收的总能量 | |
| B. | 此反应反应物的总能量高于生成物的总能量 | |
| C. | 此反应为一个吸热的反应 | |
| D. | 此反应只有在加热条件下才能进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | 铝与稀盐酸 | ||
| C. | 灼热的炭与CO2反应 | D. | 氢氧化钠溶液与醋酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是两种单质的混合物 | B. | 是共价化合物 | ||
| C. | 该新物质硬度很大 | D. | 含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
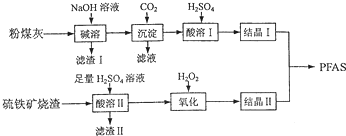
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )?
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )?| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W? | |
| C. | 原子半径:T>Q>R | |
| D. | T的最高价氧化物对应水化物为强碱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com