
| A. | 1×10-1mol/L | B. | 1×10-7mol/L | C. | 1×10-11mol/L | D. | 1×10-13 mol/L |
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物  的名称为2,6-二甲基-5-乙基庚烷 的名称为2,6-二甲基-5-乙基庚烷 | |
| B. | 符合分子式为C3H4Cl2的所有同分异构体数目为7种 | |
| C. | 丁烷、正戊烷、新戊烷、已烷的沸点依次升高 | |
| D. | 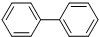 、 、 分别叫做联苯和二苯甲烷,互为同系物,两种分子的所有原子都有可能共平面 分别叫做联苯和二苯甲烷,互为同系物,两种分子的所有原子都有可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用三聚氰胺配制的奶粉 | B. | 加有大量亚硝酸钠(NaNO2)的火腿 | ||
| C. | 用碳酸钡做x射线透视的“钡餐” | D. | 加碘盐(含碘酸钾的食盐) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10NA | |
| B. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA | |
| C. | 1molHCl气体中的粒子数与0.5 mo1/L盐酸中溶质粒子数相等 | |
| D. | CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | P3>P2 T3>T2 | B. | P2>P4 T4>T2 | C. | P1>P3 T3>T1 | D. | P1>P4 T2>T3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com