
【题目】氯水中含有多种成分,因而具有多种性质,根据新制氯水分别与如图四种物质发生的反应填空(a、b、c、d、e中重合部分代表物质间反应,且氯水足量)。
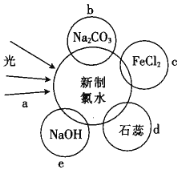
(1)氯水中含有的粒子有![]() 、
、![]() 、______、
、______、![]() 、
、![]() 、______、
、______、![]() 七种。
七种。
(2)久置的氯水变为_____________,原因是___________________________(用化学反应方程式表示)。
(3)b过程中的离子方程式是_______________________。
(4)e过程中所发生的主要反应的化学方程式为____________________________。
(5)能证明氯水具有漂白性的是______________________(填“a”“b”“c”或“d”)。
【答案】![]()
![]() 稀
稀![]()
![]() ↑
↑ ![]() ↑
↑ ![]() (或
(或![]() 或
或![]() ,任写一个都可以) d
,任写一个都可以) d
【解析】
氯气溶于水形成的溶液为氯水,新制氯水中含有三分子:![]() 、
、![]() ,
,![]() ,含有四种离子:
,含有四种离子:![]() 、
、![]() 、
、![]() 、
、![]() 。
。
(1)氯气溶于水,一部分氯气与水反应:![]() ,所以氯水中含有的粒子有
,所以氯水中含有的粒子有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(2)由于在光照条件下,![]() 可分解:
可分解:![]() ↑,所以久置的氯水变为稀
↑,所以久置的氯水变为稀![]() ,故答案为:稀
,故答案为:稀![]() ;
;![]() ↑;
↑;
(3)b过程中碳酸钠溶液中的![]() 与氯水中的
与氯水中的![]() 反应,其离子反应方程式:
反应,其离子反应方程式:![]() ↑;故答案为:
↑;故答案为:![]() ↑;
↑;
(4)e过程中氢氧化钠分别与氯水中的![]() 、
、![]() 、
、![]() 反应,其化学反应方程式为:
反应,其化学反应方程式为:![]() (或
(或![]() 或
或![]() ,任写一个都可以),故答案为:
,任写一个都可以),故答案为: ![]() (或
(或![]() 或
或![]() ,任写一个都可以);
,任写一个都可以);
(5)氯气能使湿润的蓝色石蕊试纸先变红,后褪色,能证明氯水具有漂白性可以选d,故答案为:d。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】理论上不能设计为原电池的化学反应是,注:△H<0为放热反应
A.CH4(g)+2O2(g)![]() CO2(g)+2H2O(l);△H<0
CO2(g)+2H2O(l);△H<0
B.HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(aq);△H<0
C.2H2(g)+O2(g)![]() 2H2O(g);△H<0
2H2O(g);△H<0
D.2FeCl3(l)+Fe(s)==3FeCl2(l);△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用饱和氯化钠溶液润湿的滤纸分别做甲、乙两个实验,下列判断错误的是
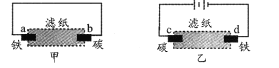
A. 甲是原电池,乙是电解池
B. 甲中铁棒比乙中铁棒更易腐蚀
C. d电极上的电极反应是:Fe-2e → Fe2+
D. b电极上的电极反应是:O2 + 2H2O + 4e → 4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下列仪器组装一套石油分馏的装置,并进行相关实验,可以得到汽油和煤油。
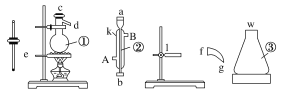
(1)写出下列仪器的名称:
①________;②________;③________。
(2)将以上仪器按从左到右的顺序,用字母a、b、c……进行连接:e接(____)接(____)接(____)接(____)接(____)接(____)接(____)接(____)接(____)。
(3)仪器②中A是________(填“进水口”或“出水口”,下同),B是________。
(4)蒸馏时,温度计水银球应在________(位置)。
(5)在①中注入原油后,加几片碎瓷片的目的是_______
(6)在实验结束后,为了探究石油中是否含有烯烃,某学生用③中的物质做了一个探究实验,其操作、现象及结论是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图。

(1)该反应的化学方程式为(反应物或生成物用符号X、Y表示):_________________________。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的点是________________。
素材1:某温度和压强下,2L容器中,发生反应2SO2+O2![]() 2SO3,不同时间点测得密闭体系中三种物质的物质的量如下:
2SO3,不同时间点测得密闭体系中三种物质的物质的量如下:
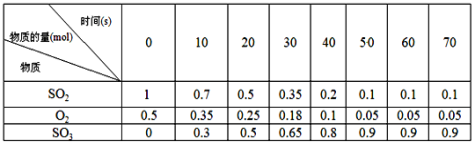
素材2:反应在不同条件下进行时SO2的转化率:(SO2的转化率是反应的SO2占起始SO2的百分数,SO2的转化率越大,化学反应的限度越大)
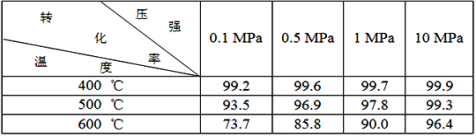
根据以上的两个素材回答问题:
(3)根据素材1中计算20~30s期间,用二氧化硫表示的化学反应平均速率为________。
(4)根据素材2中分析得到,提高该化学反应限度的途径有_______________。
(5)根据素材1、素材2中分析得到,要实现素材1中SO2的转化率需控制的反应具体条件是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料.工业上提取氧化铝的工艺流程如下:

(1)沉淀A的成分是(填化学式)_________。
(2) 步骤②中加入过量NaOH溶液发生反应的离子方程式,除了H++OH﹣=H2O还有:
_____________________________、________________________________;
(3) 步骤③中通入过量CO2气体而不加入过量盐酸的理由是___________________;
(4) 准确称取8g铝土矿样品,加入一定量试剂a的溶液,使其中的Al2O3、Fe2O3恰好溶解;然后,向滤液中加入10mol·L-1的NaOH溶液,产生沉淀的质量与加入NaOH溶液的体积关系如图所示,则样品中Al2O3的百分含量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C三种金属单质和甲、乙、丙三种气体,及物质D、E、F、G、H,它们之间能发生如图所示变化(图中有些反应的产物和反应的条件没有全部标出)。请回答下列问题:
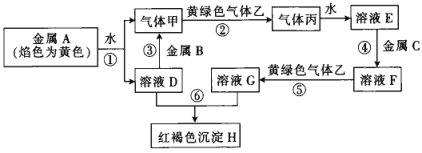
(1)写出指定物质的化学式:D____________、G____________、丙____________。
(2)上述反应中既是化合反应,又是氧化还原反应的是____________(填序号)。
(3)写出反应①的离子方程式:____________________________________。
(4)写出反应⑤的离子方程式________________________。用于检验溶液G中金属阳离子的试剂是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软锰矿的主要成分是MnO2,还含有少量金属铁、镁、铝、锌、铜的化合物等杂质。黄铁矿的主要成分是FeS2,还含有硅、铝的氧化物等杂质。工业上用软锰矿制备碳酸锰并回收硫酸铵,其主要流程如下:
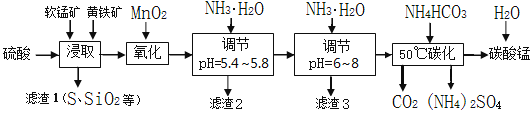
已知金属离子从开始形成氢氧化物沉淀,到沉淀时溶液的pH如下表:
金属离子 | Fe2+ | Fe3+ | Al3+ | Cu2+ | Mn2+ |
开始沉淀pH | 7.5 | 2.7 | 4.1 | 5.9 | 8.8 |
完全沉淀pH | 9.5 | 3.7 | 5.4 | 6.9 | 10.8 |
(1)提高浸出率的可采取的措施有_________。
A.适当升高温度 B.搅拌 C.加适量纯碱 D.加压
(2)浸取完成后,取浸取液少许,加入KSCN溶液无明显现象,则浸取时发生的主要反应的化学方程式是____________________________________________。
(3)调节pH为5.4~5.8的目的是_____________________________________________。
(4)滤渣3的主要成分的化学式是_____________。
(5)50℃碳化过程发生反应的离子方程式是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研团队研制出“TM﹣LiH(TM表示过渡金属)”双催化剂体系,显著提高了在温和条件下氮气和氢气合成NH3的效率,原理示意如下:
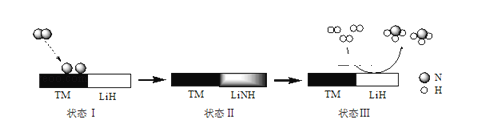
下列分析不合理的是( )
A.状态Ⅰ,吸收能量并有N≡N键发生断裂B.合成NH3总反应的原子利用率是100%
C.“TM﹣LiH”能降低合成氨反应的△HD.生成NH3:2LiNH+3H2═2LiH+2NH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com