
| A. | 酸的水溶液呈酸性;则有酸性的水溶液也一定是酸的水溶液 | |
| B. | Fe3O4可写成FeO?Fe2O3;Pb3O4也可写成PbO?Pb2O3 | |
| C. | 可电解熔融MgCl2来制取金属镁;也能电解熔融HCl来制取氢气 | |
| D. | 第2周期元素氢化物稳定性顺序是HF>H2O>NH3;则第3周期元素氢化物稳定性顺序是HCl>H2S>PH3 |
分析 A.氯化铵为强酸弱碱盐,水解呈酸性;
B.Pb的化合价为+2价、+4价,不存在+3价;
C.氯化氢是共价化合物,熔融HCl不导电;
D.元素的非金属性越强,其氢化物的稳定性越强.
解答 解:A.氯化铵为强酸弱碱盐,水解呈酸性,不是酸的水溶液,故A错误;
B.Pb的化合价为+2价、+4价,不存在+3价,Pb3O4可表示为2PbO•PbO2,故B错误;
C.氯化镁是离子晶体,可以采用电解熔融氯化镁的方法冶炼镁,但是氯化氢是共价化合物,熔融HCl不导电,故C错误;
D.元素的非金属性越强,其氢化物的稳定性越强稳定性顺序HF>H2O>NH3、HCl>H2S>PH3,推论正确,故D正确.
故选D.
点评 本题考查了类比思维方法的应用,难度不大,虽然某些物质存在相似性,但也存在差异性,要结合物质的性质来分析移动,易错选项是C,注意氯化氢是共价化合物是分子晶体而不是离子晶体,为易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 如图1是一套实验室制取乙烯验证乙烯具有还原性的实验装置,请回答:
如图1是一套实验室制取乙烯验证乙烯具有还原性的实验装置,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molO2与H2的混合气体中含有的分子数为NA | |
| B. | 1.7g NH3所含原子数为0.1NA | |
| C. | 通常状况下,11.2L N2中含有的原子数目为NA | |
| D. | 标准状况下,22.4L H2O中含有的氧原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
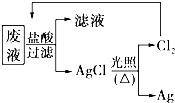 国务院强调“南水北调”工程必须坚持“三先三后”的原则.在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患.检测某工厂废液中,含有大量的Mg2+、Al3+、Cu2+、Ag+.试分析回答下列问题:
国务院强调“南水北调”工程必须坚持“三先三后”的原则.在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患.检测某工厂废液中,含有大量的Mg2+、Al3+、Cu2+、Ag+.试分析回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核磁共振仪、红外光谱仪、质谱仪、紫外光谱仪、元素分析仪、紫外可见分光光度计等都是定性或定量研究物质组成或结构的现代仪器 | |
| B. | 利用元素周期律,人们在过渡元素中寻找各种性能优良的催化剂,使反应的温度降低并提高反应物的转化率,从而起到很好的节能效果 | |
| C. | 淀粉与20%的硫酸混合溶液在沸水浴中充分加热后滴加碘水无蓝色现象,则说明淀粉水解完全 | |
| D. | 分液、蒸馏、渗析、层析及色谱法、钠融法等都是混合体系分离提纯常用的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是元素周期表的另一种画法-塔式周期表,在上面标有部分族序数及部分元素,请回答下列问题:
如图是元素周期表的另一种画法-塔式周期表,在上面标有部分族序数及部分元素,请回答下列问题:
 或
或
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com