
【题目】下列各选项中,各类物质依次表示为X、Y、Z,其中与图中三个圆所示的从属关系不相符的是:

A. 氧化物、化合物、纯净物
B. 胶体、分散系、混合物
C. 复分解反应、置换反应、化学反应
D. 碱性氧化物、金属氧化物、氧化物
科目:高中化学 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
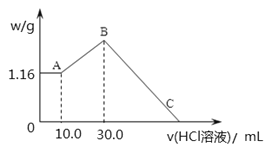
①A点的沉淀物的化学式为 。
②写出A点至B点发生反应的离子方程式: 。
③原混合物中NaOH的质量是 g,C点(此时沉淀恰好完全溶解)HCl溶液的
体积为 mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列浓度关系正确的是( )
A. 0.1mol/L的NH4HSO4溶液中滴加0.1mol/L的Ba(OH)2溶液至沉淀刚好完全:c(NH4+)>c(OH-)>c(SO42-)>c(H+)
B. 若将CO2通入0.1mol/LNa2CO3溶液至溶液中性,则溶液中: 2c(CO32-)+c(HCO3-)=0.1mol/L
C. 0.1mol/L的NaOH溶液与0.2mol/L的HCN溶液等体积混合,所得溶液呈碱性:c(Na+)>c(CN-)>c(HCN)>c(OH-)>c(H+)
D. 向1L 1mol/L的KOH热溶液中通入一定量的Cl2,恰好完全反应生成氯酸钾、次氯酸钾和氯化钾的混合溶液:c(K+)+c(H+)=6c(ClO3-)+2c(ClO-)+c(HClO)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接氨硼烷(NH3·BH3)电池可在常温下工作,装置如图。该电池的总反应为:NH3·BH3+3H2O=NH4BO2+4H2O。下列说法正确的是( )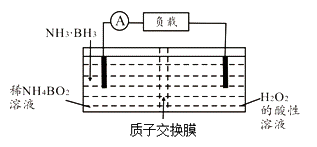
A.左侧电极发生还原反应
B.电池工作时,H+通过质子交换膜向负极移动
C.正极的电极反应式为2H++2e-=H2↑
D.消耗3.1g氨硼烷,理论上转移0.6mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语能正确表示相应意义的是( )
A.乙烯的结构简式C2H4
B.丁烷的结构简式CH3(CH2)2CH3
C.四氯化碳的结构式 ![]()
D.苯的分子式 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业采用氯化铵焙烧菱锰矿制备碳酸锰的流程如下图所示: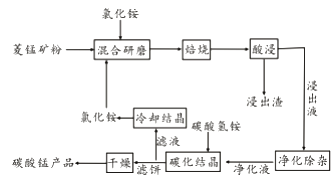
已知:①菱锰矿的主要成分是MnCO3 ,其中含Fe、Ca、Mg、Al等元素。
②焙烧过程中主要反应为:MnCO3 +2NH4Cl ![]() MnCl2+2NH3↑ +CO2↑+ H2O。
MnCl2+2NH3↑ +CO2↑+ H2O。
③部分阳离子沉淀时溶液的pH的值:
Al3- | Fe3+ | Ca2+ | Mn2+ | Mg2+ | |
开始沉淀的pH值 | 4.1 | 2.2 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH值 | 4.7 | 3.2 | 13.1 | 10.1 | 11.1 |
(1)实验室“焙烧”操作盛放固体的仪器为。
(2)结合图1、2、3,分析焙烧过程中对温度、NH4Cl用量[m(NH4Cl):m(锰矿粉)]、时间的最佳选择依次为、、。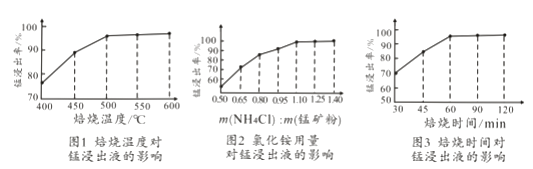
(3)对锰浸出液净化除杂时,先加入MnO2将Fe2+转化为Fe3+ , 再调节溶液pH的范围为 , 将Fe3+和Al3+变为沉淀除去。然后加入NH4F将Ca2+、Mg2+变为氟化物沉淀除去。
(4)“碳化结晶”步骤中,加入碳酸氢铵是反应的离子方程式为。
(5)上述流程中可循环使用的物质是。
(6)为测定产品中碳酸锰的含量,设计如下实验(杂质不参加反应):实验步骤为:称取16.80g试样,溶于适量的稀硫酸溶液中,向所得溶液中加入稍过量的磷酸和硝酸,加热使反应:2Mn2++NO3-+4PO43-+2H+ ![]() 2[Mn(PO4)2]3-+NO2-+H2O充分进行。除去溶液中存在的NO3-和NO2-后,加入l00.00mL2.00 mol·L-1的(NH4)2Fe(SO4)2溶液,发生的反应为:[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO3-;再用1.00mol·L-1酸性K2Cr2O7溶液滴定过量的Fe2+ , 滴定终点时消耗10.00mL酸性K2Cr2O7溶液。
2[Mn(PO4)2]3-+NO2-+H2O充分进行。除去溶液中存在的NO3-和NO2-后,加入l00.00mL2.00 mol·L-1的(NH4)2Fe(SO4)2溶液,发生的反应为:[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO3-;再用1.00mol·L-1酸性K2Cr2O7溶液滴定过量的Fe2+ , 滴定终点时消耗10.00mL酸性K2Cr2O7溶液。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程式为(还原产物是Cr3+)。
②产品中碳酸锰的质量分数为(结果保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四个试管中,发生如下反应:Zn+2HCl=ZnCl2+H2↑,产生H2的反应速率最小的是( )
试管 | 盐酸浓度 | 温度 | 锌的状态 |
A | 0.5molL﹣1 | 20℃ | 块 状 |
B | 0.5molL﹣1 | 20℃ | 粉末状 |
C | 2molL﹣1 | 35℃ | 块 状 |
D | 2molL﹣1 | 35℃ | 粉末状 |
A.A
B.B
C.C
D.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com