
【题目】钢铁工业是国家工业的基础,钢铁生锈现象却随处可见,为此每年国家损失大量资金。请回答钢铁腐蚀与防护过程中的有关问题。
(1)钢铁的电化学腐蚀原理如图所示:

①写出石墨电极的电极反应式______;
②将该装置作简单修改即可成为钢铁电化学防护的装置,请在如图虚线框内所示位置作出修改,并用箭头标出导线中电子流动方向。______
③写出修改后石墨电极的电极反应式______。
(2)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式_____。
(3)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图:

①A电极对应的金属是__(写元素名称),B电极的电极反应式是____。
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12g,则电镀时电路中通过的电子为___ mol。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因___。
【答案】O2+4e-+2H2O===4OH- ![]() 2Cl--2e-===Cl2↑ 2FeCl3+Fe===3FeCl2 铜 Cu2++2e-===Cu 0.08 铁比铜活泼,镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀
2Cl--2e-===Cl2↑ 2FeCl3+Fe===3FeCl2 铜 Cu2++2e-===Cu 0.08 铁比铜活泼,镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀
【解析】
(1)中性条件下,钢铁发生吸氧腐蚀,铁作负极,石墨作正极,正极上氧气得电子发生还原反应,要保护钢铁不受腐蚀,可以把铁设计成电解池的阴极,与电源负极相连接,设计成电解池后,石墨作阳极,阳极上氯离子放电;
(2)氧化铁可以和盐酸之间反应生成氯化铁和水,金属铁可以和氯化铁之间反应得到氯化亚铁;
(3)①在铁件的表面镀铜时,金属铜必须是阳极材料,金属铁为阴极,根据电解池的工作原理来回答;
②电镀时,电镀时,镀层连接正极,镀件连接电源负极,镀层作阳极,镀件作阴极,电解质溶液中含有镀层金属元素,阳极上发生氧化反应,阴极上发生还原反应,根据金属质量和转移电子之间的关系式计算;
③在原电池中,负极金属易被腐蚀,正极上的金属被保护。
(1)①中性条件下,钢铁发生吸氧腐蚀,该电池反应为2Fe+2H2O+O2═2Fe(OH)2,铁作负极,石墨作正极,正极上氧气得电子发生还原反应,正极反应为O2+2H2O+4e-=4OH-;
②要保护钢铁不受腐蚀,可以把铁设计成电解池的阴极,与电源负极相连接,设计成电解池后,石墨作阳极,阳极上氯离子放电,即虚线框内所示位置作出的修改以及导线中电子流动的方向如下图: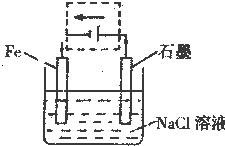 ;
;
③修改后石墨电极为阳极,氯离子放电,则电极反应式为2Cl-+2e-=Cl2↑;
(2)氧化铁可以和盐酸之间反应生成氯化铁和水,当铁锈除净后,金属铁可以和氯化铁之间反应得到氯化亚铁,即2FeCl3+Fe=3FeCl2;
(3)①在铁件的表面镀铜,金属铜必须是阳极材料,发生电极本身失电子的氧化反应,且金属铁为阴极,发生电极反应:Cu2++2e-=Cu;
②阳极上铜质量减少,阴极上铜质量增加,二者质量差为5.12g时,阴极上析出铜的质量为2.56g,根据铜和转移电子之间的关系式知,转移电子的物质的量=![]() ×2=0.08mol;
×2=0.08mol;
③镀铜铁中由于铁比铜活泼,镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀,但是镀锌的铁镀层破损后,金属Zn为负极,金属铁为正极,正极金属被保护。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是( )
A. 乙醛溶液与新制氢氧化铜碱性悬浊液共热: CH3CHO + 2Cu(OH)2 + OH- ![]() CH3COO- + Cu2O↓+ 3H2O
CH3COO- + Cu2O↓+ 3H2O
B. 碳酸钠溶液与醋酸反应:CO32- + 2H+ = CO2↑+ H2O
C. 用Fe除去FeCl2溶液中的少量的FeCl3杂质:Fe+Fe3+=2Fe2+
D. 将1~2mL氯化铁饱和溶液加到20mL沸水中:Fe3+ + 3H2O = Fe(OH)3(胶体) + 3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计,其指针总是偏向电源正极。

(1)As(砷)位于元素周期表中第4周期第ⅤA族,则Na3AsO4溶液的pH_________(填“>”“<”或“=”)7。
(2)向B杯中加入适量较浓的硫酸,发现G的指针向右偏移。此时A杯中的主要实验现象是_____,D电极上的电极反应式为___________。
(3)一段时间后,再向B杯中加入适量的质量分数为40%的氢氧化钠溶液,发现G的指针向左偏移。此时整套实验装置的总的离子方程式为________________。
(4)再过一段时间后,G的指针逐渐归零,此时实验装置中的化学反应已经达到化学平衡状态,该反应的化学平衡常数的表达式为:K=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,反应aX(g)![]() bY(g)+cZ(g)达到平衡状态,其他条件不变,把容器体积压缩到原来的1/2,且达到新的平衡状态时,X的物质的量浓度从0.1 mol/L增大到0.19 mol/L,下列判断正确的是
bY(g)+cZ(g)达到平衡状态,其他条件不变,把容器体积压缩到原来的1/2,且达到新的平衡状态时,X的物质的量浓度从0.1 mol/L增大到0.19 mol/L,下列判断正确的是
A. a=b+c B. a=b=c C. a>b+c D. a<b+c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是
A. 由C(石墨,s)=C(金刚石,s)ΔH = +1.9 kJ·mol-1可知,金刚石比石墨稳定
B. 已知S(g)+O2(g)═SO2(g) ΔΗ1 ;S(s)+O2(g)═SO2(g) ΔΗ2 ,则ΔΗ1<ΔΗ2
C. 在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)![]() 2H2O(l) ΔH = +285.8 kJ·mol-1
2H2O(l) ΔH = +285.8 kJ·mol-1
D. 在稀溶液中:H +(aq)+OH -(aq)= H2O(l)ΔH =-57.3 kJ·mol-1,若将含1mol CH3COOH与含1mol NaOH的溶液混合,放出的热量等于57.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子化合物G是一种聚酯材料,其一种合成路线如下:

回答下列问题:
(1)A的名称是________,B含有的官能团名称是________。
(2)反应④的反应类型是________。
(3)反应⑥的化学方程式为________。
(4)反应③⑤中引入-SO3H的作用是________。
(5)满足下列条件的C的同分异构体共有________种(不含立体异构)。
①能使FeCl3溶液显紫色;能发生水解反应。②苯环上有两个取代基。
其中核磁共振氢谱显示为5组峰,峰面积之比为3:2:2:2:1,且含有-CH2CH3,该有机物的结构简式是________ (任写一种)。
(6)以CH3CH2CH2OH为原料,设计制备 的合成路线:________。
的合成路线:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO![]() 。关于该物质的说法正确的是( )
。关于该物质的说法正确的是( )
A. 该物质属于两性氢氧化物
B. 该物质是Al(OH)3和Na2CO3的混合物
C. 1 mol NaAl(OH)2CO3最多可消耗3 mol H![]()
D. 该药剂不适合于胃溃疡患者服用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.能使甲基橙变红的溶液中:K+、Mg2+、NO3-、I-
B.c(HCO3-)=1 mol·L-1溶液中:Na+、NH4+、SO42-、OH-
C.无色透明的溶液中: Fe3+、Al3+、NO3-、SO42-
D.![]() =1012的溶液中:Na+、Ba2+、Cl-、AlO2-
=1012的溶液中:Na+、Ba2+、Cl-、AlO2-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com