
分析 (1)稀释促进一水合氨的电离,铵根离子浓度大于原来的$\frac{1}{10}$;
(2)氨水中存在NH3+H2O?NH3•H2O?NH4++OH-,向氨水中加入含有铵根离子抑制一水合氨电离,温度不变,水的离子积常数不变;一水合氨与氢离子反应生成铵根离子和水;铵根离子水解浓度减小,氯离子不水解;
(3)根据物料守恒和电荷守恒分析;
(4)醋酸和一水合氨的电离平衡常数相同,醋酸的酸性大于碳酸,则碳酸氢根离子的水解程度大于铵根离子,据此判断醋酸铵溶液的酸碱性;
(5)氢氧化镁和氯化铵反应生成氯化镁和一水合氨.
解答 解:(1)在25℃条件下将pH=10的氨水稀释10倍,溶液中铵根离子浓度减小,稀释促进一水合氨的电离,所以铵根离子浓度大于原来的$\frac{1}{10}$,所以溶液的pH应该9-10之间;
故答案为:C;
(2)氨水中存在NH3+H2O?NH3•H2O?NH4++OH-,向氨水中加入含有铵根离子抑制一水合氨电离,所以NH3•H2O的电离平衡向左移动;温度不变,则水的离子积常数Kw 不变;一水合氨与氢离子反应生成铵根离子和水,其反应的离子方程式为:NH3•H2O+H+=NH4++H2O;铵根离子水解浓度减小,溶液显酸性,氯离子不水解,则溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
故答案为:向左;不变;NH3•H2O+H+=NH4++H2O;c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(3)室温下,将0.1mol NH4Cl晶体溶于一定量水中,形成2L混合溶液(假设无气体逸出),溶液的浓度为0.05mol/L,由物料守恒可知c(NH${\;}_{4}^{+}$)+c(NH3•H2O)=(Cl-)=0.05mol/L;溶液中电荷守恒为:c(Cl-)+c(OH-)=c(H+)+c(NH4+),则c(H+)+c(NH${\;}_{4}^{+}$)-c(OH-)=c(Cl-)=0.05mol/L;
故答案为:0.05mol/L;0.05mol/L;
(4)醋酸和一水合氨的电离平衡常数相同,醋酸的酸性大于碳酸,则碳酸氢根离子的水解程度大于铵根离子,碳酸氢根离子水解显碱性,则NH4HCO3溶液呈碱性;
故答案为:碱;
(5)氢氧化镁和氯化铵反应生成氯化镁和一水合氨,反应的离子方程式为Mg(OH)2(s)+2NH4+═Mg2++2NH3•H2O,
故答案为:Mg(OH)2(s)+2NH4+=Mg2++2NH3•H2O.
点评 本题考查了弱电解质电离、水解原理的应用,涉及离子方程式、盐的水解原理的应用、离子浓度大小的比较等知识点,根据弱电解质的电离特点及盐类水解特点来分析解答,注意:平衡常数只与温度有关,与溶液酸碱性无关,为易错点.


 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | M一定是强电解质 | B. | M一定是弱电解质 | C. | M一定是某种盐 | D. | M一定是某种强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
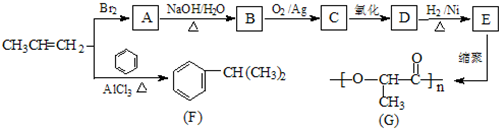
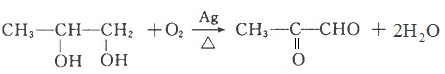 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 973K | 1173K |
| K1 | 1.47 | 2.15 |
| K2 | 2.33 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
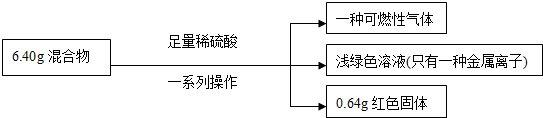
| A. | 原混合物中铜元素的质量不一定为0.64g | |
| B. | 生成气体体积为2.016L | |
| C. | 实验中反应的硫酸的物质的量为0.1mol | |
| D. | 原混合物中铁的质量分数为87.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10g CO和10g N2 | B. | 10g C2H4和10g C3H6 | ||
| C. | 5.6L O2(标准状况)和0.5mol H2O | D. | 224mL He(标准状况)和1.6g CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热 | B. | 加HCl | C. | 加NaOH | D. | 加AlCl3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com