
| |||||||||||
(1) |
c(HNO3)==4.00mol·L-1 |
(2) |
解:由实验②与实验①的数据分析,平均每失1mol电子溶解的金属的质量为:
该值小于Cu的32g·mol-1,大于Fe的28g·mol-1,所以,溶解的金属是铁与铜的混合物.8.00g金属是铜.当溶解8.00g铜时(固体恰好全部溶解),据方程式①得: 消耗n(HNO3)= V[HNO3(aq)]= 所以,实验③共用稀硝酸:200mL+83.3mL=283L.共产生气体:4.48L+1.87L=6.35L. 据题意,实验②比实验①多溶解的金属中有如下关系: 56n(Fe)+64n(Cu)=9.2g 2[n(Fe)+n(Cu)]=0.1mol×3解得:在溶解的9.2g金属中有铁0.050mol,铜0.10mol 当加入400mL稀硝酸时,金属完全被氧化,在实验③的基础上,金属元素再失电子:
稀硝酸再被还原产生NO:V(NO)=0.20mol×
所以,实验④共产生气体6.35L+1.49L=7.84L |


科目:高中化学 来源: 题型:
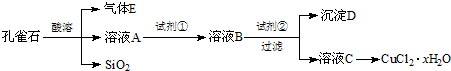
| Fe3+ | Cu2+ | Fe2+ | |
| 开始沉淀的pH | 2.7 | 5.4 | 8.1 |
| 沉淀完全的pH | 3.7 | 6.9 | 9.6 |
| 80a-135b |
| 18b |
| 80a-135b |
| 18b |
查看答案和解析>>
科目:高中化学 来源: 题型:

| Fe3+ | Cu2+ | Fe2+ | |
| 开始沉淀的pH | 2.7 | 5.4 | 8.1 |
| 沉淀完全的pH | 3.7 | 6.9 | 9.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
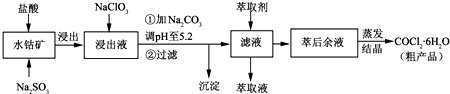
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
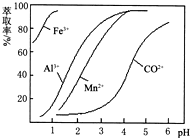
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验操作 |
| I | 取一定质量的FeCO3固体置于坩埚中,高温燃烧至质量不再减轻,冷却至室温. |
| II | 取少量实验步骤I所得固体放于一洁净的试管中,用足量的稀硫酸溶解. |
| III | 向实验步骤II所得溶液中滴加KSCN溶液,溶液变红. |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
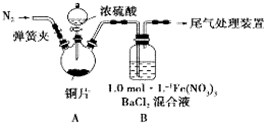 我省从2013年12月1日零时起,车用汽油升级为“国Ⅳ”标准,汽油中的硫含量下降三分之二,对二氧化硫的排放有了大大的改善,SO2可以用Fe( NO3)3溶液吸收,某化学兴趣小组对SO2和 Fe( NO3)3 溶液的反应[0.1mol/L的Fe(NO3)3 溶液的 pH=2]做了相应探究.
我省从2013年12月1日零时起,车用汽油升级为“国Ⅳ”标准,汽油中的硫含量下降三分之二,对二氧化硫的排放有了大大的改善,SO2可以用Fe( NO3)3溶液吸收,某化学兴趣小组对SO2和 Fe( NO3)3 溶液的反应[0.1mol/L的Fe(NO3)3 溶液的 pH=2]做了相应探究.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com