
在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |

(1)写出该反应的平衡常数表达式:K=____________。已知:K300℃>K350℃,则该反应是____________热反应。
(2)图中表示NO2变化的曲线是__________。用O2表示从0~2 s内该反应的平均速率v=__________。
(3)能说明该反应已达到平衡状态的是__________。
a. v(NO2)=2v(O2)
b.容器内压强保持不变
c. v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂
答案 (1)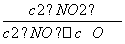 放
放
(2)b 1.5×10-3mol·L-1·s-1
(3)bc
(4)c
解析 (1)由K300℃>K350℃,说明升高温度平衡常数减小,则化学平衡向逆反应方向移动,该反应为放热反应。
(2)由于NO2的变化量与NO的变化量相等,是O2变化量的2倍,但曲线的变化方向相反,因此可确定b线是NO2的变化曲线。v(O2)=0.5v(NO)=0.5×(0.020mol-0.008mol)/(2 L×2 s)=1.5×10-3mol·L-1·s-1。
(3)化学平衡状态是各成分的含量保持不变的状态,实质是正、逆反应速率相等。a项中v(NO2)=2v(O2)任何情况下均成立,不能用来判断是否达到平衡;该反应反应前后体积有变化,故当容器内压强保持不变时,说明反应达到了平衡状态,故b项可以;c项中v逆(NO)=2v正(O2)说明正、逆反应速率相等,可以说明反应达到了平衡状态;因为容器是密闭的,故反应前后质量一定不变,体积不变,故密度始终保持不变,因此不能用来判断是否达到平衡状态。
(4)为使该反应的反应速率增大,可采取增大浓度、压强等方法,故a项不正确;催化剂虽然能使该反应的反应速率增大,但不影响平衡移动,故d项错误;因该反应为放热反应,故升高温度,平衡逆向移动,b项错误,c项正确。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
在200 mL某硫酸盐溶液中,含有1.5NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属离子。则该硫酸盐的物质的量浓度为 ( )
A.1 mol·L-1 B.2.5 mol·L-1
C.5 mol·L-1 D.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
自然界的矿物、岩石的形成和变化受到许多条件的影响。地壳内每加深1 km,压强增大约25000~30000 kPa。在地壳内SiO2和HF存在以下平衡:
SiO2(s)+4HF(g)SiF4(g)+2H2O(g)
ΔH=-148.9 kJ·mol-1
如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,下列说法不正确的是( )
A.2v正(HF)=v逆(H2O)
B.v正(H2O)=2v逆(SiF4)
C.SiO2的质量保持不变
D.容器内压强不变
查看答案和解析>>
科目:高中化学 来源: 题型:
利用反应2NO(g)+2CO(g)2CO2(g)+N2(g) ΔH=-746.8 kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是( )
A.降低温度
B.增大压强同时加催化剂
C.升高温度同时充入N2
D.及时将CO2和N2从反应体系中移走
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应A+B—→C,如果温度每升高10 ℃,反应速率增加为原来的3倍。在10 ℃时,完成反应的20%需要54 min;将温度提高到40 ℃,完成反应的20%需要的时间为( )
A.2 min B.3 min
C.6 min D.9 min
查看答案和解析>>
科目:高中化学 来源: 题型:
在100mL混合液中,HNO3和H2SO4物质的量浓度分别是0.4mol/L和0.1mol/L,向该混合液中加入1.92gCu粉,加热充分反应后,所得溶液中Cu2+的物质的量浓度是( )
A.0.15 mol/L B. 0.45 mol/L C.0.35 mol/L D.0.225 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法或表示方法正确的是( )
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的能量多
B.由H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1可知,若将含1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3 kJ
C.由C(石墨)===C(金刚石) ΔH=1.9 kJ·mol-1可知,金刚石比石墨稳定
D.在100 kPa时,1 g H2完全燃烧生成液态水,放出285.8 kJ热量,则H2燃烧的热化学方程式表示为:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com