
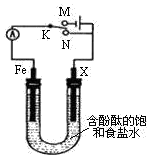
| A. | 电键K置于N处,若X为铜棒,可实现铁棒免受腐蚀 | |
| B. | 电键K置于N处,若X为锌棒,铁棒上发生的电极反应式为O2+2H2O+4e-═4OH- | |
| C. | 电键K置于M处,若X为碳棒,碳棒附近溶液变红 | |
| D. | 电键K置于M处,若X为铜棒,可实现在铁棒上镀铜 |
分析 若电键K与N连接,该装置没有外接电源,所以构成了原电池;组成原电池时,较活泼的金属铁作负极,负极上铁失电子发生氧化反应;石墨棒作正极,正极上氧气得电子生成氢氧根离子发生还原反应;
若电键K置于M处,为电解装置,Fe与负极相连,作阴极被保护,X与电源正极相连为阳极,以此来解答.
解答 解:A.电键K置于N处,该装置没有外接电源,构成原电池,若X为铜棒,较活泼的金属铁作负极,负极上铁失电子生成二价铁离子进入溶液,所以铁不被保护,故A错误;
B.电键K置于N处,构成原电池;若X为锌棒,Fe作正极,正极上氧气得电子生成氢氧根离子发生还原反应,电极反应式为2H2O+O2+4e-═4OH-,故B正确;
C.电键K置于M处,若X为碳棒,该装置是电解池,发生2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2 ↑,阳极上生成氯气,碳棒附近由黄绿色气体生成,故C错误;
D.电键K置于M处,若X为铜棒,Cu是电解池的阳极,铁棒是阴极,电解质溶液换成CuSO4溶液就可以实现铁棒上镀铜,如果电解质溶液仍然是氯化钠溶液,不能实现铁棒上镀铜,故D错误;
故选B.
点评 本题考查电解原理及应用,为高频考点,把握与N或M相连构成的装置、电极反应为解答的关键,侧重分析与应用能力的考查,注意选项D为易错点,题目难度不大.


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | H2RO3 | B. | H2RO4 | C. | HRO3 | D. | HRO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 组别 | 甲 | 乙 | 丙 |
| A | Al2O3 | HNO3 | NaOH |
| B | N2 | O2 | NH3 |
| C | SiO2 | KOH | HF |
| D | SO2 | Ba(OH)2 | NaHCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和乙烯都能使溴水褪色,且反应原理相同 | |
| B. | 乙炔和苯均为不饱和烃,都只能发生加成反应 | |
| C. | 乙烯和氯乙烯都可以通过聚合反应得到高分子材料 | |
| D. | 分子式为C10H14苯环上只有一个取代基的芳香烃,其可能的结构有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18g金属铝由原子变为离子时失去的电子数为NA | |
| B. | 在通常条件下,1mol氩气含有的原子数为2NA | |
| C. | 在标准状况下,2.24 L氨气所含的电子总数约为NA | |
| D. | 含有NA个原子的镁在足量的二氧化碳气体中充分燃烧生成固体的质量为40g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
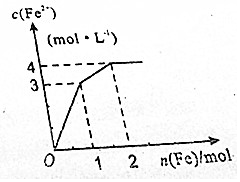 在Fe2(SO4)3和CuSO4的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示.若不考虑溶液体积变化,下列说法错误的是( )
在Fe2(SO4)3和CuSO4的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示.若不考虑溶液体积变化,下列说法错误的是( )| A. | 溶液体积为2L | B. | n(SO42-)=4mol | ||
| C. | c【Fe2(SO4)3】:c【CuSO4】=1:1 | D. | 氧化性:Fe3+>Cu2+>Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8.1g | B. | 3.6g | C. | 4.05g | D. | 2.7g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com