
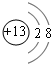
 如图是NaCl晶体的一个晶胞结构棋型,KO2的晶体结构与NaCl的相似,KO2可以看做是Na+的位置被K+代替,Cl-的位置被O2-代替代替.则下列关于KO2晶体结构的叙述中正确的是( )
如图是NaCl晶体的一个晶胞结构棋型,KO2的晶体结构与NaCl的相似,KO2可以看做是Na+的位置被K+代替,Cl-的位置被O2-代替代替.则下列关于KO2晶体结构的叙述中正确的是( )| A. | 与K+距离相等且最近的O2-有8个 | |
| B. | 与K+距离相等且最近的O2-构成的多面体是六面体 | |
| C. | 一个KO2晶胞中的K+和O2-的粒子数都是4个 | |
| D. | 与K+距离相等且最近的K+有8个 |
分析 K+离子直径大于O2-,K+位于晶胞定点、面心,O2-位于晶胞的棱和体心,结合均摊法判断晶胞含有K+和O2-的个数,结合晶胞结构判断配位数,以此解答该题.
解答 解:A.由晶胞图可知,以晶胞上方面心的K+离子为研究对象,其平面上与其距离最近的O2-有4,上方和下方各有一个,共有6个,故A错误;
B.与K+距离相等且最近的O2-共有6个,构成正八面体,K+位于正八面体中心,故B错误;
C.K+离子位于顶点和面心,数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,O2-离子位于棱心和体心,数目为12×$\frac{1}{4}$+1=4,即每个晶胞中含有4个K+和4个O2-,故C正确;
D.K+位于晶胞棱心,则被横平面、竖平面和正平面共有,且每一个平面有4个K+距离最近,共4×3=12个,故D错误.
故选C.
点评 本题考查了晶胞的计算,为高频考点,侧重于学生的分析能力的考查,明确顶点、棱、面心上每个原子被几个晶胞占有是解本题关键,难度中等.


科目:高中化学 来源: 题型:选择题
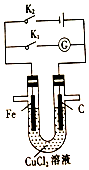
| A. | 同时打开K1、K2,铁棒上有紫红色物质析出 | |
| B. | 只闭合K1,石墨棒上有紫红色物质析出 | |
| C. | 只闭合K2,当电路中通过0.3mol电子时,两极共产生4.48L(标准状况)气体 | |
| D. | 只闭合K2,一段时间后,将电解质溶液搅拌均匀,溶液的pH变大(不考虑Cl2的溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ).
).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | 相关信息 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是其内层电子数的三倍 |
| C | 在第3周期元素中,C的简单离子半径简单最小 |
| D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌 | |
| B. | 溶剂蒸发的速率越快,或浓缩后的溶液冷却得越快,析出的晶体颗粒就越大 | |
| C. | 油脂在热NaOH溶液中完全水解后加入饱和食盐水,可观察到液面上有固体析出 | |
| D. | 制备NaCl晶体时,晶体表面含有少量KNO3,用水淋洗后可得到较纯净的NaC1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
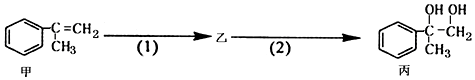
| A. | 物质丙能与氢氧化钠溶液反应 | |
| B. | 甲和丙均可使酸性KMnO4溶液褪色 | |
| C. | 反应(2)属于取代反应 | |
| D. | 步骤(2)产物中可能含有未反应的甲,可用溴水检验是否含甲 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com