
| 实验操作 | 现象 | 结论 | |
| A | 在淀粉溶液中加入稀硫酸加热一段时间后冷却至室温,再加入碘水. | 溶液变蓝 | 说明淀粉没有水解 |
| B | 将乙醇与酸性重铬酸钾(K2Cr2O7)溶液混合 | 橙色溶液变为绿色 | 乙醇具有还原性 |
| C | 蔗糖溶液中加入稀硫酸,水解后加入银氨溶液,水浴加热 | 未出现银镜 | 水解的产物中没有葡萄糖 |
| D | 将新制Cu(OH)2与葡萄糖溶液混合加热 | 产生红色沉淀(Cu2O) | 葡萄糖具有氧化性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.溶液变蓝说明含有淀粉;
B.重铬酸钾(K2Cr2O7)溶液为橙色,三价铬离子为绿色;
C.银镜反应需要在碱性条件下进行;
D.新制Cu(OH)2与葡萄糖溶液混合加热产生红色沉淀(Cu2O).
解答 解:A.溶液变蓝说明含有淀粉,证明水解需要检验葡萄糖,故A正确;
B.重铬酸钾(K2Cr2O7)溶液为橙色,三价铬离子为绿色,化合价降低,说明乙醇化合价升高,有还原性,故B正确;
C.银镜反应需要在碱性条件下进行,所以应该先加氢氧化钠溶液中和稀硫酸,再加入银氨溶液,故C错误;
D.新制Cu(OH)2与葡萄糖溶液混合加热产生红色沉淀(Cu2O),说明葡萄糖有还原性,故D错误.
故选AB.
点评 本题考查化学实验评价,难度不大,注意新制Cu(OH)2与葡萄糖溶液混合加热产生红色沉淀(Cu2O),说明葡萄糖有还原性.


科目:高中化学 来源: 题型:解答题
| 化学键 | O=O | C=O | H=O | C=H |
| E/(kJ mol-1) | 496 | 799 | 460 | ? |
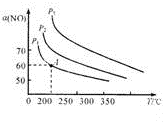 | 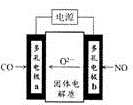 | 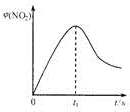 |
| 图1 | 图2 | 图3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 澄清石灰水中加少量碳酸氢钠:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | H218O中投入Na2O2固体:2H218O+2Na2O2═4Na++4OH-+18O2↑ | |
| D. | 碳酸钠的水解反应:CO32+H3O+?HCO3-+H2O3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
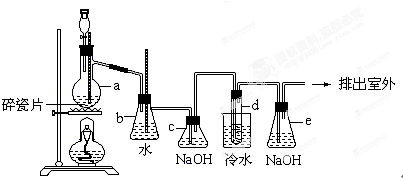
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
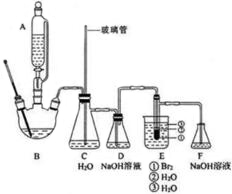 1,2-二溴乙烷是常用的有机合成中间体,某小组用如下装置合成1,2-二溴乙烷.
1,2-二溴乙烷是常用的有机合成中间体,某小组用如下装置合成1,2-二溴乙烷.| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 1,2-二溴乙烷 | 131.4 | 2.18 | 微溶 |
| 溴 | 58.8 | 3.12 | 微溶 |
| 乙醇 | 78.5 | 0.79 | 溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.1 g由白磷和红磷组成的混合物中含有磷原子的数目为0.1NA | |
| B. | 0.1 mol丙烯醛中含有双键的数目为0.1 NA | |
| C. | 标准状况下,2.24 L乙醇中含有分子的数目为0.1NA | |
| D. | 0.1 mol的氯气全部溶于水后转移电子的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{W}{W+18a}$×100% | B. | $\frac{W}{W+36a}$×100% | C. | $\frac{W}{161(W+18a)}$×100% | D. | $\frac{W}{161(W+36a)}$×100% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com