
| A、阿司匹林具有解热镇痛作用 |
| B、可以用Si3N4、Al2O3制作高温结构陶瓷制品 |
| C、禁止使用四乙基铅作汽油抗爆震剂,可减少汽车尾气污染 |
| D、在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀 |


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
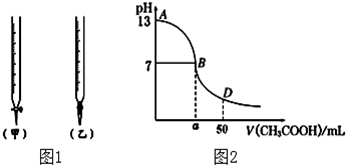
| 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 | |
| A | 碱 | 酸 | 石蕊 | (乙) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 酚酞 | (甲) |
| D | 酸 | 碱 | 石蕊 | (乙) |
| 待测氢氧化钠 | 0.100mol/L醋酸的体积 | ||
| 滴定次数 | 溶液的体积(mL) | 滴定前的刻度(mL) | 滴定后的刻度(mL) |
| 第一次 | 25.00 | 0.00 | 24.98 |
| 第二次 | 25.00 | 1.56 | 27.86 |
| 第三次 | 25.00 | 0.22 | 25.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、D、E、F、G是原子序数依次增大的六种短周期元素.A和B能形成B2A和B2A2两种化合物,B、D、G的最高价氧化物对应水化物两两之间都能反应,D、F、G原子最外层电子数之和等于15.
A、B、D、E、F、G是原子序数依次增大的六种短周期元素.A和B能形成B2A和B2A2两种化合物,B、D、G的最高价氧化物对应水化物两两之间都能反应,D、F、G原子最外层电子数之和等于15.查看答案和解析>>
科目:高中化学 来源: 题型:
A、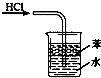 用于吸收HCl气体 |
B、 用于除去NO2中的NO |
C、 配制1mol/L NaCl溶液定容操作 |
D、 滴有淀粉碘化钾溶液的纸蝴蝶变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 条件一定时,反应2A(g)+B(g)?2C(g),B的转化率α与温度T变化关系曲线图如图所示,图中4个点中,表示未达到平衡状态,且V正<V逆的点是( )
条件一定时,反应2A(g)+B(g)?2C(g),B的转化率α与温度T变化关系曲线图如图所示,图中4个点中,表示未达到平衡状态,且V正<V逆的点是( )| A、a | B、b | C、c | D、d |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com