
有一含NaCl、Na2CO3•10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数.
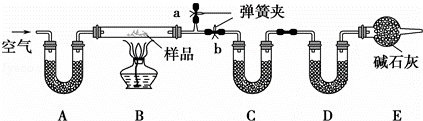
(1)加热前通入空气的目的是 ,操作方法为 .
装置A、C、D中盛放的试剂分别为:A ,C ,D .
(3)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl的含量将 (填“偏高”、“偏低”或“无影响”,下同);若B中反应管右侧有水蒸气冷凝,则测定结果中NaHCO3的含量将 ;若撤去E装置,则测得Na2CO3•10H2O的含量将 .
(4)若样品质量为wg,反应后C、D增加的质量分别为m1g、m2g,由此可知混合物中NaHCO3的质量分数为 % (用含w、m1、m2的代数式表示).
考点: 探究碳酸钠与碳酸氢钠的性质;探究物质的组成或测量物质的含量.
专题: 实验设计题.
分析: 将混合物加热会产生H2O(g)、CO2等气体,应在C、D中分别吸收,由干燥剂的性质知应先吸收水,再吸收二氧化碳,即C中的干燥剂吸水后不能吸收CO2;由D的增重(NaHCO3分解产生的CO2的质量)可求出NaHCO3质量.由C的增重(Na2CO3•10H2O分解产生的H2O及已经知道的NaHCO3分解产生的H2O的质量)可求出Na2CO3•10H2O的质量,从而求出NaCl的质量;故应在实验前想法赶出装置中的空气,关键操作应是赶B中的空气,所以关闭b,打开a就成为操作的关键,缓缓通入则是为了赶出效果更好;E中碱石灰可防止外界空气中的H2O(g)、CO2进入装置D影响实验效果,
根据以上分析进行解答(1)(3);
(4)装置D中增加的质量为二氧化碳的质量,根据反应方程式2NaHCO3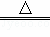 Na2CO3+CO2↑+H2O计算出碳酸氢钠的质量,再计算出碳酸氢钠的质量分数.
Na2CO3+CO2↑+H2O计算出碳酸氢钠的质量,再计算出碳酸氢钠的质量分数.
解答: 解:(1)本实验中需要分别测定反应生成的二氧化碳和水的质量,所以实验前必须将装置中的水蒸气和二氧化碳赶走,避免影响测定结果;操作方法为:关闭b,打开a,缓缓通入空气,直至a处出来的空气不再使澄清石灰水变浑浊为止,
故答案为:除去装置中的水蒸气和二氧化碳;关闭b,打开a,缓缓通入空气,直至a处出来的空气不再使澄清石灰水变浑浊为止;
装置A用于吸收空气中的二氧化碳和水,可以使用碱石灰;装置C吸收Na2CO3•10H2O和NaHCO3分解生成的水蒸气,可以使用无水硫酸铜;装置D吸收碳酸氢钠分解生成的二氧化碳,可以用碱石灰,
故答案为:碱石灰;无水硫酸铜(或无水CaCl2、P2O5等);碱石灰;
(3)若将A装置换成盛放NaOH溶液的洗气瓶,则m(H2O)增加,使Na2CO3•10H2O和NaHCO3的含量偏高,NaCl的含量偏低;
若B中反应管右侧有水蒸气冷凝,测定碳酸钠的质量是根据装置D中质量变化计算的,与水蒸气的量无关,则测定结果中NaHCO3的含量不变;
E中碱石灰可防止外界空气中的H2O(g)、CO2进入装置D,若撤去E装置,则测定的碳酸氢钠的质量偏大,碳酸氢钠分解生成水的质量偏高,而Na2CO3•10H2O的测定是根据生成水的总质量计算的,则测得Na2CO3•10H2O的含量将偏低,
故答案为:偏低;无影响;偏低;
(4)若样品质量为wg,反应后C、D增加的质量分别为m1g、m2g,则碳酸氢钠分解生成的二氧化碳的质量为m2g,
2NaHCO3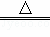 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
168 44
m(NaHCO3) m2g
m(NaHCO3)= =
= g,
g,
混合物中NaHCO3的质量分数为: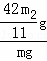 ×100%=
×100%= %,
%,
故答案为: %.
%.
点评: 该本题综合考查元素化合物性质、测定混合物中各成分的质量分数,题目难度中等,解题时必须结合实验装置和物质的性质进行综合分析,综合考查学生实验能力和分析能力,注意把握物质的性质以及实验原理.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
对由X、Y元素形成的化合物X2Y2的叙述正确的是()
A. 若是离子化合物,则阳阴离子个数比肯定不等于1:1
B. 若该化合物有Y﹣Y键,则肯定是共价化合物
C. 若溶于水时有X﹣Y键的断裂,则肯定是强电解质
D. 若X、Y原子间的共价键键能大,则熔、沸点肯定高
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
A. Cl2通入水中:Cl2+H2O═2H++Cl﹣+ClO﹣
B. 双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I﹣═I2+2H2O
C. 用铜作电极电解CuSO4溶液:2Cu2++2H2O 2Cu+O2↑+4H+
2Cu+O2↑+4H+
D. Na2S2O3溶液中加入稀硫酸:2S2O32﹣+4H+═SO42﹣+3S↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
利用实验器材(规格和数量不限)能完成相应实验的一项是( )
选项 实验器材(省略夹持装置) 相应实验
A 烧杯、玻璃棒、蒸发皿 CuSO4溶液的浓缩结晶
B 烧杯、玻璃棒、胶头滴管、滤纸 用盐酸除去BaSO4中少量的BaCO3
C 烧杯、玻璃棒、胶头滴管、容量瓶 用固体NaCl配制0.5mol•L﹣1的溶液
D 烧杯、玻璃棒、胶头滴管、分液漏斗 用溴水和CCl4除去NaBr溶液中少量的NaI
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
①钠在空气中燃烧生成白色的固体氧化钠
②钠投入硫酸铜溶液中有红色粉末产生
③过氧化钠可在防毒面具中做供氧剂
④铁丝在氯气中燃烧产生大量红棕色的烟
⑤氢气在氯气中燃烧能产生大量的白烟.
A. ①② B. ②③ C. ③④ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
同温同压下两个容积相等的贮气瓶,一个装有C2H4,另一个装有C2H2和C2H6的混合气体,两瓶内的气体一定具有相同的( )
A. 质量 B. 原子总数 C. 碳原子数 D. 密度
查看答案和解析>>
科目:高中化学 来源: 题型:
取少量Fe2O3粉末(红棕色)加 入适量盐酸,发生反应的化学方程式: ,反应后得到的溶液呈黄色.用此溶液分别做如下实验:
(1)取少量溶液置于试管中,NaOH溶液,可观察到有红褐色沉淀生成,反应的化学方程式为
此反应属于 .
(2)在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈 色,即制得Fe(OH)3胶体
(3)取另一只小烧杯也加入20mL蒸馏水,向烧杯中加入1mL FeCl3溶液,振荡均匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置于暗处,分别用激光笔照射烧杯中的液体,可以看到乙烧杯中的液体产生丁达尔效应.这个实验可以用来区别胶体和溶液.
(4)取乙烧杯中少量Fe(OH)3胶体置于试管中,向试管中滴加一定量的稀HI溶液,边滴加边振荡,会出现一系列变化.
①先出现红褐色沉淀,原因是 .
②随后沉淀溶解,溶液呈黄色,写出此反应的离子方程式: .
③最后溶液颜色加深,原因是 .(用离子方程式表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com