
分析 任何化学反应中都遵循质量守恒定律,根据方程式知,该反应中生成R、M的物质的量之比为1:2,R和M的摩尔质量之比为22:9,则生成4.4克R时同时生成M质量=$\frac{4.4g}{22}$×2×9=3.6g,根据质量守恒定律计算Y质量,然后得出Y与M的质量之比,据此分析解答.
解答 解:任何化学反应中都遵循质量守恒定律,根据方程式知,该反应中生成R、M的物质的量之比为1:2,R和M的摩尔质量之比为22:9,则生成4.4克R时同时生成M质量为:$\frac{4.4g}{22}$×2×9=3.6g,根据质量守恒定律得Y质量=4.4g+3.6g-1.6g=6.4g,此反应中Y和M的质量比=6.4g:3.6g=16:9,
故答案为:3.6g;16:9;质量守恒定律.
点评 本题考查化学方程式有关计算,明确各个物理量关系是解本题关键,侧重考查学生分析计算能力,易错点是M质量的计算,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 若溶质为NaA,溶液中可能存在:c (OH-)=c(H+)+c(HA) | |
| B. | 若c(OH-)>c(H+),溶液中不可能存在c(Na+)>c(OH-)>c(A-)>c(H+) | |
| C. | 溶液中可能存在c(Na+)>c(A-)>c(H+)>c(OH-) | |
| D. | 若溶质为NaA和HA,则一定存在c(A-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于80% | B. | 略小于80% | C. | 略大于80% | D. | 等于20% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸易溶于水,而乙烷难溶于水 | |
| B. | 乙烯能发生加成反应,乙烷不能发生加成反应 | |
| C. | 甲苯能使高锰酸钾溶液褪色,甲烷和苯不能使高锰酸钾溶液褪色 | |
| D. | 乙醛与Ag(NH3)2 OH 1:2 反应.而甲醛为 1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
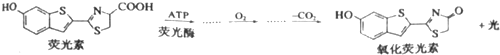
| A. | 互为同系物 | B. | 均可发生硝化反应 | ||
| C. | 均可与碳酸氢钠反应 | D. | 均最多有7个碳原子共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com