
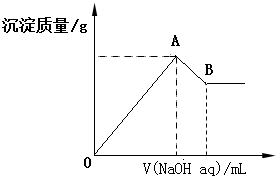
| A. | x=$\frac{2a}{5-a}$ | |
| B. | x的取值范围是0<x<$\frac{11}{32}$ | |
| C. | A点横坐标的值随x发生变化 | |
| D. | 若B点横坐标为200mL时,c(NaOH)=7.0mol/L |
分析 A、溶液中Al3+的物质的量为a mol,利用电荷守恒用a表示出Mg2+的物质的量,溶液中离子总的物质的量为三种离子之和,得到x和a的关系;
B、溶液中Al3+的物质的量为a mol,利用电荷守恒用a表示出Mg2+的物质的量,溶液中离子总的物质的量为三种离子之和,也等于$\frac{a}{x}$mol,据此列等式计算a的值(用x表示),利用极限法计算x的取值范围;
C、溶液中铝离子的物质的量一定,消耗氢氧化钠的量是一定值;
D、根据铝元素守恒计算氢氧化铝溶解消耗的氢氧化钠的物质的量,进而计算浓度即可.
解答 解:A、Al3+的物质的量为a mol,根据电荷守恒:n(Cl-)+2n(SO42-)=2n(Mg2+)+3n(Al3+),解得2n(Mg2+)=0.6mol+1.6mol-3amol=(2.2-3a)mol,n(Mg2+)=(1.1-1.5a)mol,所以Al3+的物质的量与混合溶液中离子总物质的量的比值为x,即x=$\frac{a}{a+0.6+0.8+1.1-1.5a}$=$\frac{2a}{5-a}$,故A正确;
B、溶液中Al3+的物质的量为a mol,由电荷守恒可知Mg2+的物质的量为(1.1-1.5a)mol,x=$\frac{2a}{5-a}$,a<$\frac{2.2}{3}$,解得x的取值范围是:0<x<$\frac{11}{32}$,故B正确;
C、,因为溶液中氯离子、硫酸根离子物质的量一定,A点时镁离子、铝离子完全被转化为沉淀,则溶液中的溶质转化为氯化钠、硫酸钠,所以A点横坐标的值不会随x发生变化,故C错误;
D、Al3+的物质的量为a mol,最终消耗氢氧化钠是4amol,n(Mg2+)=(1.1-1.5a)mol,消耗氢氧化钠是(2.2-3a)mol,共消耗氢氧化钠是a+2.2mol,所以若B点横坐标为200mL时,c(NaOH)=$\frac{a+2.2}{0.2}$mol/L,故D错误.
故选AB.
点评 本题考查混合物的有关计算,题目难度中等,注意利用守恒进行的计算,B为易错点,可以直接利用极限法分析判断x的最大值不能取等号.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 某芳香烃的分子式为C10H14,它不能使溴水褪色,但可使酸性KMnO4溶液褪色,且分子结构中只有一个烷基,符合条件的烃有3种 | |
| B. | 当溶液中的氨基酸主要以两性离子的形态存在时,它在水中的溶解度最小,可以形成晶体析出.不同的氨基酸出现这种情况的pH各不相同,利用这一差别,可以通过调节溶液pH分离某些氨基酸 | |
| C. | 有机硅聚醚 (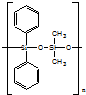 )可由单体 )可由单体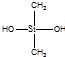 和 和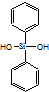 缩聚而成 缩聚而成 | |
| D. | 等质量的甲醇、甲醛、二甲醚完全燃烧时的耗氧量依次递增 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上制取玻璃的工艺是应用了物质酸性的差异 | |
| B. | 家庭里可用淀粉检验加碘盐是否含有碘 | |
| C. | 铁是人体必需的微量元素,所以可以适当地吃点铁锈 | |
| D. | 王水是由浓盐酸和浓硝酸两种物质按3:1的体积比混合配制成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 53.8% | B. | 58.3% | C. | 60.3% | D. | 70.0% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为防止富脂食品氧化变质,常在包装袋中放入生石灰 | |
| B. | 铬是人体必需的微量元素,但铬过量会危害人体健康,其中六价铬的毒性最大.人体内六价铬超标,可以服用维生素C缓解毒性,说明维生素C具有氧化性 | |
| C. | 去年冬天的雾霾天气严重影响了人们的正常出行和生活节奏.为改善空气质量,可以加高工厂的烟囱,使烟尘和废气远离地表 | |
| D. | 硅酸钠是最简单的硅酸盐,是制备硅胶和木材防火剂的原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | b电极上发生还原反应 | |
| B. | 外电路电子的流向是从a到b | |
| C. | 电池工作时,盐桥中的SO42-移向甲烧杯 | |
| D. | a电极上发生的反应为:MnO4-+8H++5e-═Mn2++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
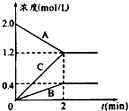 表示800℃时含有A、B、C三种气体的体系中各物质浓度(mol/L)随时间变化的情况如图所示
表示800℃时含有A、B、C三种气体的体系中各物质浓度(mol/L)随时间变化的情况如图所示查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素的原子最外电子层上有6个电子 | |
| B. | 该元素最高正价氧化物的化学式为RO2 | |
| C. | 该元素一定是非金属元素 | |
| D. | 该元素最高价氧化物的对应水化物的化学式为H2RO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com