
A、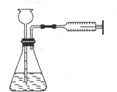 装置气密性的检查 |
B、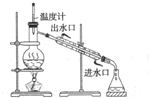 碘的CCl4溶液中分离I2,并回收CCl4 |
C、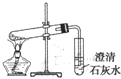 探究NaHCO3 |
D、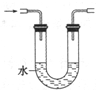 氨气的吸收 |


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
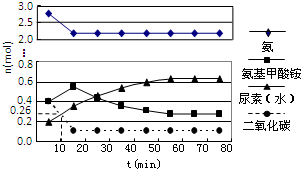 尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应分为如下两步:
尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应分为如下两步:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等量的CH4和Cl2在光照下反应生成纯净的CH3Cl |
| B、将苯与浓硝酸和浓硫酸共热制取硝基苯 |
| C、将红热的铜丝迅速插入无水乙醇中可将乙醇氧化为乙醛 |
| D、可用浓硝酸鉴别淀粉溶液和鸡蛋白溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 充电 |
| ||
| ||
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
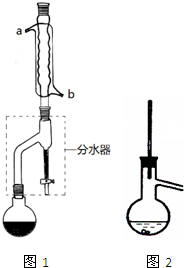 乙酸正丁酯常用作织物、人造革和塑料生产过程中的溶剂,石油和医药工业中的萃取剂,也用于香料复配以及香蕉、菠萝、杏、梨等多种香味剂的成分.实验室制备乙酸正丁酯的化学方程式为:
乙酸正丁酯常用作织物、人造革和塑料生产过程中的溶剂,石油和医药工业中的萃取剂,也用于香料复配以及香蕉、菠萝、杏、梨等多种香味剂的成分.实验室制备乙酸正丁酯的化学方程式为:| 浓H2SO4 |
| △ |
| 浓H2SO4 |
| △ |
| 化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
| 密度/g?mL-1 | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸点/℃ | 117.8 | 118.1 | 126.1 | 143 |
| 在水中的溶解性 | 易溶 | 易溶 | 难溶 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
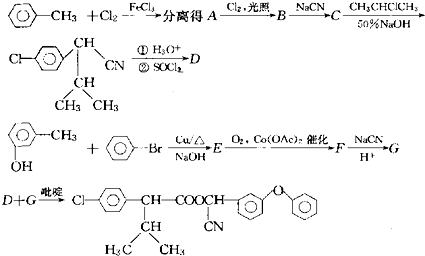
| ①H3O+ |
| ②SOCl2 |
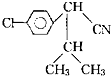
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③④ | B、①③④⑤ |
| C、③④⑤⑥ | D、①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硝酸应保存在棕色试剂瓶里 |
| B、铵态氮肥不宜与碱性肥料混合施用 |
| C、常温下铁、铝不与浓硝酸反应 |
| D、NO可用排水法收集,NO2可用向上排空气法收集 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com