
| A、向NaAlO2溶液中通入足量的CO2气体:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| B、向FeSO4酸性溶液中加入过氧化氢溶液:2Fe2++H2O2+2H+=2Fe3++2H2O |
| C、向溴水中通入SO2气体:SO2+Br2+2H2O=2H++SO42-+2HBr |
| D、FeS加入稀硫酸中:S2-+2H+=H2S |


科目:高中化学 来源: 题型:
| A、Na2O与Na2O2都能与水反应生成碱,它们都是碱性氧化物 |
| B、Na2CO3溶液和NaHCO3溶液都能与CaCl2溶液反应得到白色沉淀 |
| C、钠在常温下不容易被氧化 |
| D、Na2O2可作供氧剂,而Na2O不行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X与Y形成的分子中既含有极性共价键又含有非极性共价键 |
| B、X的气态氢化物比Y的气态氢化物稳定 |
| C、X与R、Y与R均能形成阴阳离子数目之比为1:1的化合物 |
| D、R、X、Y三种元素可形成化学式为RXY3、R(X2Y4)2的两种盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、150 mL 1 mol?L-1 NaCl溶液 |
| B、75 mL 1 mol?L-1CaCl2溶液 |
| C、150 mL 2 mol?L-1 KCl溶液 |
| D、75 mL 1 mol?L-1AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| C(H+)?C(CH3COO-) |
| C(CH3COOH) |
| C(H+)?C(HS-) |
| C(H2S) |
| C(H+)?C(S2-)2- |
| C(HS-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
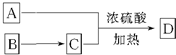 所示转化关系,D的分子式为C10H12O3,A与C反应的化学方程式
所示转化关系,D的分子式为C10H12O3,A与C反应的化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:
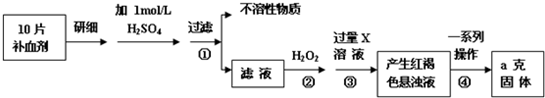
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com