
【题目】下列指定反应的离子方程式正确的是( )
A.少量的SO2通入到Ca(ClO)2溶液中:Ca(ClO)2 + SO2 + H2O ═ CaSO3↓+ 2HClO
B.室温下,测得氯化铵溶液pH<7,因为NH4+ + 2H2O NH3·H2O + H3O+
C.吸氧腐蚀负极的电极反应式为:Fe - 3e- ═ Fe3+
D.用碳酸氢钠溶液检验水杨酸中的羧基: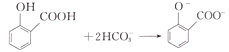
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为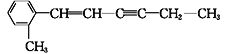 。下列关于该有机物分子结构的说法中正确的是
。下列关于该有机物分子结构的说法中正确的是
A. 最多有18个原子在同一平面内 B. 最多有4个碳原子在一条直线上
C. 最多有12个碳原子在同一平面内 D. 所有原子都可能在同一平面内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物I(分子式为C19H20O4)属于芳香酯类物质,是一种调香剂,其合成路线如下:
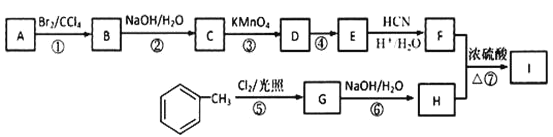
已知:①A 属于脂肪烃,核磁共振氢谱显示有 2 组峰,面积比为 3:1,其蒸气密度是相同条件下 H2 的 28 倍;D 分子式为C4H8O3;E 分子式为 C4H6O2,能使溴水褪色。
②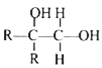
![]()
 其中 R 为烃基。
其中 R 为烃基。
③![]()
![]()
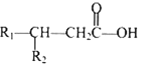 其中 R1 和 R2 均为烃基。
其中 R1 和 R2 均为烃基。
回答下列问题:
(1)A 的结构简式为_______。
(2)D 中官能团的名称是_______。
(3)反应②化学方程式为_______。
(4)E的同系物K 比E 多一个碳原子,K有多种链状同分异构体,其中能发生银镜反应且能水解的有_______种。
(5)反应①~⑦属于取代反应的是_______ (填序号)。
(6)反应⑦的化学方程式为_______。
(7)参照上述合成路线,以![]() 原料(无机试剂任选),经 4 步反应制备可降解塑料
原料(无机试剂任选),经 4 步反应制备可降解塑料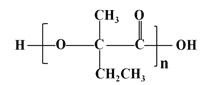 _______ (例如合成流程CH3CH2Br
_______ (例如合成流程CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3)
CH3COOCH2CH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读下列材料,按要求回答问题:酒精、苯(密度小于水,且不溶于水)、CCl4都是有机溶剂,液溴Br2和碘(I2)皆难溶于水,都易溶于上述有机溶剂。
(1)在酒精、苯、NaCl溶液3种试剂中:能把溴单质从溴水中萃取出来的是________,萃取时上层液体呈________色,下层液体呈________色。
(2)乙醇和乙酸可以互溶,若要分离两者,可通过蒸馏实现,请指出图中实验装置中的错误之处:①________________;②______________;③________________。
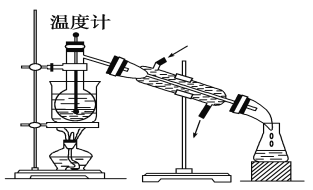
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组拟合成除草剂苯达松和染料中间体X。

已知信息:

(1)下列说法正确的是___。
A.化合物B到C的转变涉及到取代反应 B.化合物C具有两性
C.试剂D可以是甲醇 D.苯达松的分子式是C10H10N2O3S
(2)化合物F的结构简式是________。
(3) 写出E+G→H的化学方程式______。
(4)写出分子式为C6H13NO2,同时符合下列条件的同分异构体的结构简式,写出2个即可_____。
①分子中有一个六元环,且成环原子中最多含2个非碳原子;
②1H﹣NMR谱和IR谱检测表明分子中有4种化学环境不同的氢原子。有N﹣O键,没有过氧键(﹣O﹣O﹣)。
(5)设计以CH3CH2OH和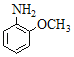 为原料制备X(
为原料制备X( )的合成路线(无机试剂任选,合成中须用到上述①②两条已知信息,用流程图表示)。_____
)的合成路线(无机试剂任选,合成中须用到上述①②两条已知信息,用流程图表示)。_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三种常见元素的性质或结构如下表:
X | 与Al同周期,金属性最强 |
Y | 与Al同周期,最外层电子数是最内层电子数的3倍 |
Z | 常温下单质为双原子分子,为黄绿色有毒气体 |
W | 单质紫黑色,遇淀粉溶液显蓝色 |
(1)X元素的名称是___;Y的原子结构示意图是___;W在元素周期表中的位置是___;
(2)请写出Z的单质与X元素最高价氧化物所对应水化物的溶液在常温下反应的离子方程式___;
(3)判断非金属性Z___Y(填“>”或“<”),请用离子方程式进行说明:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴(Co)的氧化物是一种重要的化工原料,工业上利用反应CoCO3+O2![]() CoxOy+CO2来生产相应的钴的氧化物。实验室中可以用下列装置来制取钴的氧化物并测定其分子组成。
CoxOy+CO2来生产相应的钴的氧化物。实验室中可以用下列装置来制取钴的氧化物并测定其分子组成。
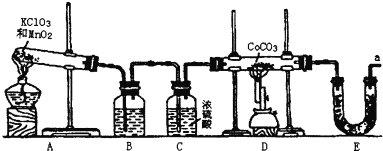
请填写下列空白:
(1)写出A装置的大试管里发生反应的化学方程式___;
(2)E装置的U形管里盛放的物质是___;
A.P2O5 B.无水CaCl2 C.碱石灰 D.无水CuSO4
(3)O3的氧化性比O2强。已知制得的O2中含有少量的Cl2和O3,则B装置中所盛放的物质是___;
A.NaOH溶液 B.饱和NaHCO3溶液 C.饱和NaCl溶液 D.KI溶液
(4)实验结束时,若先撤去A装置中的酒精灯,会引起___;
(5)在CoCO3完全转化为CoxOy后,若称得E管增重4.40g,D管内残留物质的质量是8.30g,则生成CoxOy的化学式为___;请写出详细的计算过程。
(6)此实验装置存在一个比较大的缺陷,如何完善___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:p(Ba2+) ═ -lgc(Ba2+),p(X2-) ═ -lgc(X2-) ,Ksp(BaSO4)<Ksp(BaCO3),常温下BaSO4、BaCO3的溶解平衡曲线如图所示,下列叙述中正确的是( )
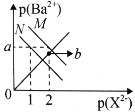
A.M线为BaCO3的溶解平衡曲线B.b点对应的溶液中Ba2+、SO42-不能形成BaSO4沉淀
C.Ksp(BaSO4) > 10-(1+a)D.BaSO4(s)+CO32-(aq) ![]() BaCO3(s)+SO42-(aq)的K=0.1
BaCO3(s)+SO42-(aq)的K=0.1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物(如NO2、N2O4、N2O5等)应用很广,在一定条件下可以相互转化。
(1)已知:N2O5在一定条件下发生分解2N2O5(g) ![]() 4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
T/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N2O5)/mol·L-1 | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
设反应开始时体系压强为p0,第2.00 min时体系压强为p,则p∶p0=________;1.00~3.00 min内,O2的平均反应速率为________。
(2)在N2O4与NO2之间存在反应:N2O4(g)![]() 2NO2(g)。将1 mol的N2O4放入1 L的恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
2NO2(g)。将1 mol的N2O4放入1 L的恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
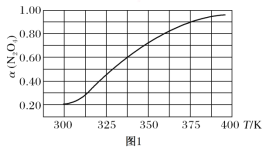
①337.5 K时,反应的平衡常数K=________(填写计算结果)。
②据图推测N2O4(g) ![]() 2NO2(g)是吸热反应,理由是_______________。
2NO2(g)是吸热反应,理由是_______________。
③对于反应N2O4(g)![]() 2NO2(g),用平衡时各组分压强关系表达的平衡常数
2NO2(g),用平衡时各组分压强关系表达的平衡常数![]() 。在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2· [p(NO2)]2。其中,k1、k2是与反应及温度有关的常数。相应的速率—压强关系如图所示:一定温度下,k1、k2与平衡常数Kp的关系是k1=________,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由___。
。在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2· [p(NO2)]2。其中,k1、k2是与反应及温度有关的常数。相应的速率—压强关系如图所示:一定温度下,k1、k2与平衡常数Kp的关系是k1=________,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由___。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com