
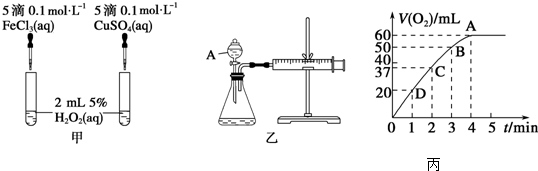
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
分析 (1)a.钠、沸石等可放回原试剂瓶;
b.带有活塞、玻璃塞且用于盛液体的仪器,应检漏;
c.灼烧固体应在坩埚中进行;
d.硝酸根离子在酸性条件下具有强氧化性,可氧化SO32-生成SO42-;
e.萃取碘时不能用裂化汽油;
(2)①向溶液中滴加足量氯水后,溶液变橙色,说明溶液中含有Br-,且有无色气泡冒出,说明溶液中含CO32-;
②向所得橙色溶液中加入足量BaCl2溶液,有沉淀生成,说明含SO32-;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色,可能是碘离子氧化成单质碘,进一步单质碘被氧化成碘酸根离子或溶液中不含I-,所以溶液不变色,不能确定碘离子存在;
(3)①要对比试验效果,那么除了反应的物质的量不一样以外,要保证其它条件相同,而且是探究硫酸铜量的影响,那么每组硫酸的量要保持相同,六组反应的总体积也应该相同;
②生成的单质Cu会沉积在Zn的表面,影响了反应速率.
解答 解:(1)a.实验时并不是多有的药品都不能放回,如钠、沸石等可放回原试剂瓶,故a错误;
b.带有活塞、玻璃塞且用于盛液体的仪器,应检漏,故b正确;
c.灼烧固体应在坩埚中进行,故c错误;
d.硝酸根离子在酸性条件下具有强氧化性,可氧化SO32-生成SO42-,应先加入盐酸,除去SO32-,然后再加入氯化钡检验,故d错误;
e.裂化汽油含有碳碳双键,可与发生加成反应,萃取碘时不能用裂化汽油,故e错误,
故答案为:acde;
(2)①向溶液中滴加足量氯水后,溶液变橙色,说明溶液中含有Br-,且有无色气泡冒出,说明溶液中含离子CO32-;
②向所得橙色溶液中加入足量BaCl2溶液,沉淀生成,说明含SO32-,被氧化生成SO42-,与钡离子反应生成BaSO4沉淀,
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色,可能是碘离子氧化成单质碘,进一步单质碘被氧化成碘酸根离子或溶液中不含I-,所以溶液不变色,不能确定碘离子存在;
溶液中含有CO32-、SO32-,则一定不含有Al3+、Mg2+,因反应生成沉淀,
根据溶液呈电中性原则,溶液中一定含有Na+,
所以溶液中一定不存在的离子为Al3+、Mg2+,一定含有的离子为CO32-、Br-、Na+、SO32-,
故答案为:CO32-、Br-、Na+、SO32-;
(3)①要对比试验效果,那么除了反应的物质的量不一样以外,要保证其它条件相同,而且是探究硫酸铜量的影响,那么每组硫酸的量要保持相同,六组反应的总体积也应该相同.A组中硫酸为30ml,那么其它组硫酸量也都为30ml.而硫酸铜溶液和水的总量应相同,F组中硫酸铜20ml,水为0,那么总量为20ml,所以V6=10ml,V9=17.5ml,V1=30ml,
故答案为:30;10;17.5;
②因为锌会先与硫酸铜反应,直至硫酸铜反应完才与硫酸反应生成氢气,硫酸铜量较多时,反应时间较长,而且生成的铜会附着在锌片上,会阻碍锌片与硫酸继续反应,氢气生成速率下降,
故答案为:当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与H2SO4溶液的接触面积而使反应速率下降.
点评 本题考查了化学实验方案的评价以及物质的检验,影响化学反应速率的因素,并且融合了化学实验,形式新颖灵活,为高频考点,涉及物质的分离、性质实验及实验基本技能等,把握物质的性质及实验基本操作为解答的关键,侧重实验技能的考查,本题的易错点在于第(3)小题,首先V1、V6、V9的求得要注意分析表中数据;最后一问应该能够想到“覆盖”的问题,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
 按要求完成下列问题:
按要求完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素最高价氧化物的水化物肯定是一种强酸 | |
| B. | 该元素单质肯定是一种黄绿色的气体 | |
| C. | 该元素的最高价氧化物肯定能与强碱反应 | |
| D. | 该元素的原子半径在同周期中肯定是最小的(稀有气体元素除外) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
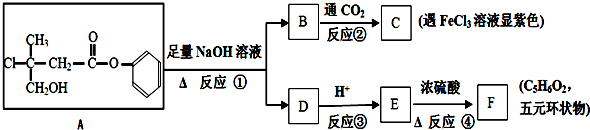
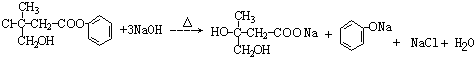 .
.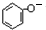 +CO2+H2O→
+CO2+H2O→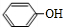 +HCO3-.
+HCO3-. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
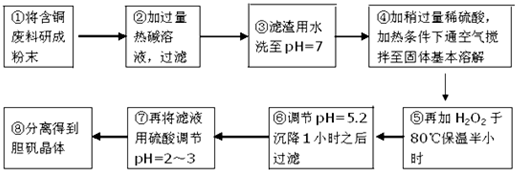
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 | Fe(OH)2 |
| pH | 5.2 | 3.1 | 6.7 | 9.4 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S气体能用浓硫酸进行干燥(浓硫酸的吸水性) | |
| B. | 铜与浓硝酸制备NO2气体(浓硝酸的强氧化性、酸性) | |
| C. | SO2的水溶液能够使品红溶液褪色(H2SO3的强氧化性) | |
| D. | 可口可乐瓶盖打开后,有大量气体逸出(H2CO3的挥发性) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com