

 (1)FeCl3具有净水作用,但腐蚀设备,FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)2Fe3++Fe=3Fe2+.
(1)FeCl3具有净水作用,但腐蚀设备,FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)2Fe3++Fe=3Fe2+.
分析 (1)钢铁设备中的Fe会与铁离子反应生成亚铁离子;
(2)氯酸钠氧化酸性的氯化亚铁,则反应物中有氢离子参加,则生成物中有水生成,Cl元素的化合价从+5价降低到-1价,得到6个电子,而Fe元素的化合价从+2价升高到+3价,失去1个电子,根据得失电子守恒,则氯酸根离子的系数为1,Fe2+的系数为6,则铁离子的系数也是6,氯离子的系数是1,根据电荷守恒,则氢离子的系数是6,水的系数是3;
(3)足量Cl2通入和KOH溶液中,温度低时发生反应Cl2+2OH-=Cl-+ClO-+H2O,向溶液I中加入KOH,使氯气完全反应,且将溶液转化为碱性溶液,只有碱性条件下次氯酸根离子才能和铁离子发生氧化还原反应生成高铁酸根离子,除去KCl得到碱性的KClO浓溶液,向碱性的KClO浓溶液中加入90%的Fe(NO3)3溶液,发生反应2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,得到溶液II,纯化得到湿产品,将湿产品洗涤、干燥得到晶体K2FeO4.
①根据过滤的操作步骤分析所用仪器,玻璃仪器有漏斗、烧杯和玻璃棒;
②KOH和氯气反应生成KClO,除去未反应的氯气,且只有碱性条件下,铁离子才能和次氯酸根离子发生氧化还原反应生成高铁酸根离子;
③Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,可起到净水的作用;
(4)电解时阳极Fe失电子发生氧化反应,电极反应方程式为Fe+8OH--6e-═FeO42-+4H2O;
(5)装置为原电池,若用d装置保护铁,X极的电极材料应比铁活泼.
解答 解:(1)铁离子具有氧化性,钢铁设备中的Fe会与铁离子反应生成亚铁离子,离子方程式是:2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+;
(2)氯酸钠氧化酸性的氯化亚铁,则反应物中有氢离子参加,则生成物中有水生成,Cl元素的化合价从+5价降低到-1价,得到6个电子,而Fe元素的化合价从+2价升高到+3价,失去1个电子,根据得失电子守恒,则氯酸根离子的系数为1,Fe2+的系数为6,则铁离子的系数也是6,氯离子的系数是1,根据电荷守恒,则氢离子的系数是6,水的系数是3,配平后离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O,
故答案为:1;6;6H+;1;6;3H2O;
(3)①过滤,玻璃仪器有漏斗作过滤器,烧杯盛放待过滤液、和过滤液,玻璃棒作用为引流,
故答案为:漏斗、烧杯、玻璃棒;
②KOH和氯气反应生成KClO,除去未反应的氯气,且只有碱性条件下,铁离子才能和次氯酸根离子发生氧化还原反应生成高铁酸根离子,所以加入KOH的目的是除去氯气且使溶液为后一步反应提供碱性,
故答案为:为下一步反应提供反应物;
③铁酸钠被还原后的产物Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,可起到净水的作用,Fe3+水解离子方程式为:Fe3++3H2O?Fe(OH)3(胶体)+3H+,
故答案为:Fe3++3H2O?Fe(OH)3(胶体)+3H+;
(4)电解时阳极Fe失电子发生氧化反应,电极反应方程式为Fe+8OH--6e-═FeO42-+4H2O,故答案为:Fe+8OH--6e-═FeO42-+4H2O;
(5)装置为原电池,若用d装置保护铁,X极的电极材料应比铁活泼可以选择锌,故答案为:A.
点评 本题考查了氧化还原反应、原电池和电解池原理、物质的分离与提纯等,题目难度中等,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力,注意基础知识的掌握.


科目:高中化学 来源: 题型:解答题
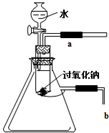 用脱脂棉包住0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来.
用脱脂棉包住0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅溶于水显酸性 | |
| B. | 二氧化碳通入水玻璃(Na2SiO3的水溶液)可以得到白色胶状物质 | |
| C. | 因为高温时,二氧化硅与碳酸钠反应放出二氧化碳,所以硅酸的酸性比碳酸强 | |
| D. | 二氧化硅是酸性氧化物,它不溶于任何酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 学习化学应该明确“从生活中来,到生活中去”的道理.
学习化学应该明确“从生活中来,到生活中去”的道理.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13.3% | B. | 26.6% | C. | 20% | D. | ≥20% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若c(CH3COOH)=0.1mol/L,反应后的溶液中:c(CH3COO-)+c(OH-)=c(Na+)+c(H+) | |
| B. | 若c(CH3COOH)=0.1mol/L,反应后的溶液中:c(OH-)>c(CH3COOH)+c(H+) | |
| C. | 若c(CH3COOH)=0.2mol/L,反应后的溶液中:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+) | |
| D. | 若反应后的溶液呈中性,则:c(CH3COOH)+c(CH3COO-)>0.05mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol A+1mol B | |
| B. | 1mol C+1mol D | |
| C. | 2mol C+2mol D | |
| D. | 0.5mol A+0.5mol B+0.5mol C+1mol D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com