
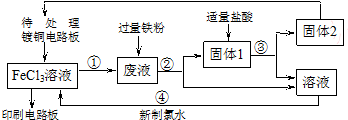
分析 待处理镀铜电路板与氯化铁溶液反应后得到的溶液中含有氯化铜、氯化亚铁及未反应的氯化铁,废液中加入足量的Fe,反应中铁离子和铜离子均可铁粉反应:2Fe3++Fe═3Fe2+,Cu2++Fe=Cu+Fe2+,过滤得到的固体1为生成的铜和过量的铁,加入适量盐酸后过滤,Fe与盐酸反应,而Cu不反应,过滤得到固体2为铜及氯化亚铁溶液,新制氯水把氯化亚铁氧化,得到氯化铁溶液.(2)中检验溶液中Fe3+存在通常用KSCN溶液,溶液变红说明Fe3+存在,据此解答.
解答 解:待处理镀铜电路板与氯化铁溶液反应后得到的溶液中含有氯化铜、氯化亚铁及未反应的氯化铁,废液中加入足量的Fe,反应中铁离子和铜离子均可铁粉反应:2Fe3++Fe═3Fe2+,Cu2++Fe=Cu+Fe2+,过滤得到的固体1为生成的铜和过量的铁,加入适量盐酸后过滤,Fe与盐酸反应,而Cu不反应,过滤得到固体2为铜及氯化亚铁溶液,新制氯水把氯化亚铁氧化,得到氯化铁溶液.
(1)镀铜电路版制成印刷电路版是利用氯化铁溶液和铜反应生成氯化亚铁和氯化铜而实现的,离子方程式为2Fe3++Cu═Cu2++2Fe2+,废液中含有铁离子和铜离子均可以与过量铁粉反应,滤得到的固体1为生成的铜和过量的铁,
故答案为:2Fe3++Cu═Cu2++2Fe2+; Fe、Cu;
(2)反应①为铜与氯化铁溶液反应生成氯化亚铁和氯化铁,化学方程式为:2FeCl3+Cu=2FeCl2+CuCl2,检验溶液中Fe3+存在通常用KSCN溶液,取少量溶液与试管中,滴加KSCN溶液,溶液变红说明Fe3+存在,
故答案为:2FeCl3+Cu=2FeCl2+CuCl2;KSCN;
(3)反应④是新制氯水把氯化亚铁氧化为三氯化铁,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-.
点评 本题考查化学工艺流程、物质分离提纯综合应用、元素化合物性质等知识,侧重于铁离子和亚铁离子的转化,题目难度中等,注意基础知识的理解掌握.


 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:多选题
| A. | 将木炭粉碎成粉末状可以加快化学反应速率 | |
| B. | 升高温度可以加快化学反应速率 | |
| C. | 增加压强可以加快化学反应速率 | |
| D. | 增加木炭的量可以加快化学反应速 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
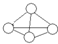 白磷分子如图所示,则31g白磷分子中存在的共价键数目是( )
白磷分子如图所示,则31g白磷分子中存在的共价键数目是( )| A. | 4NA | B. | NA | C. | 1.5NA | D. | 0.25NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将铁与一定量的浓硫酸加热时,观察到铁完全溶解得到溶液A,并产生大量气体B.
铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将铁与一定量的浓硫酸加热时,观察到铁完全溶解得到溶液A,并产生大量气体B.| 实验操作 | 预期现象 | 结 论 | |
| 验证猜想Ⅰ | ①取适量A溶液,滴加0.1mol/LKSCN溶液 ②另取适量A溶液,滴加少量0.01mol/L酸性KMnO4溶液 | ①酸性高锰酸钾溶液褪色,说明含有亚铁离子; ②溶液变为血红色 | 含有Fe2+和Fe3+ |
| 验证猜想Ⅱ | 将所得气体通入下图所示装置 | 甲中紫色褪去,乙中不褪色,试管中收集到气体 | 含有两种气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 反应 | △H/kJ•mol-1 | △S/J•K-1•mol-1 |
| ① | -72.1 | +220 |
| ② | +149 | +41 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com