

| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(×10-4mol?L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)(×10-3mol?L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
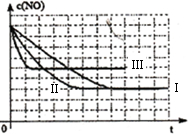
| 实验编号 | T/℃ | NO初始浓度/mol?L-1 | CO初始浓度/mol?L-1 | 催化剂的比表面积/m2?g-1 |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 |
| 6mol |
| 5 |
| 4.5×10-4×(9×10-4)2 |
| (1×10-4)2×(9×10-4)2 |
 ,
, .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
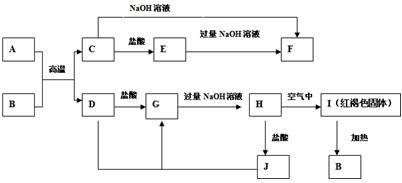
| ||
| ||
| △ |
| A、O2MnO2KMnO4 |
| B、KMnO4MnO2O2 |
| C、MnO2KMnO4O2 |
| D、O2KMnO4MnO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在0℃,压强为101×105Pa时,22.4L Cl2与HCl的混合气体中含有的氯原子总数为3NA |
| B、0.5molI-被氧化时失去的电子数为0.5NA |
| C、0.1L3 mol?L-1的NH4NO3溶液中含有的NH4+数目为0.3×6.02×1023 |
| D、常温常压下,48gO3含有氧原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶解的铁粉为2.8g |
| B、原溶液中c(SO42-)=0.5mol/L |
| C、原混合溶液中c(H+)=1.2mol/L |
| D、原溶液中n(NO3-)=0.08mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、往溶液中加入过量的氯水再加淀粉,振荡不出现蓝色,说明没有I- |
| B、往FeI2溶液中滴加少量氯水时的离子反应式为:2I+Cl2=I2+2Cl |
| C、往某溶液中加入稀盐酸.产生的气体能使澄清石灰水变浑浊,说明该溶液中有CO32-或HCO3- |
| D、往溶液中先加入稀HNO3,再加BaCl2溶液,有白色沉淀生成,说明有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
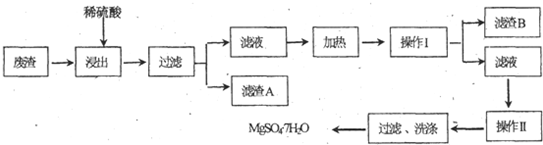

查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| Ka | 1.8×10-5 | 4.9×10-10 | K1:4.3×10-7 K2:5.6×10-11 |
| A、相等物质的量浓度溶液pH关系:pH (NaCN)>pH (Na2CO3)>pH (CH3COONa) |
| B、相等物质的量浓度的HCN和NaCN混合溶液中:c (HCN)+c(H+)=c (OH-)+c (CN-) |
| C、a mol/LHCN与b mol/LNaOH溶液等体积混合后所得的溶液中:若c(Na+)>c (CN-),则a一定小于b |
| D、将Na2CO3加入到HCN溶液中时发生如下反应:Na2CO3+HCN=NaCN+NaHCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com