
| A、原溶液中的Br-一定被氧化 |
| B、通入氯气之后原溶液中的Fe2+一定被氧化 |
| C、溶液中一定不存在Fe2+ |
| D、若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3 溶液,能产生黄色沉淀 |


科目:高中化学 来源: 题型:
| A、海水中蕴含的元素有80多种,其中Mg、Br、I在海水中的总储量分别约为1.8×1015t、1×1014t、8×1010t.由于海水中镁的储量很大,工业上常以海水为原料提取镁,因此,镁元素被称为“海洋元素” | |||
B、对于可逆反应N2(g)+3H2(g)
| |||
| C、硫酸工业中,从吸收塔上部导出的气体再次通入接触室进行二次氧化,进一步吸收后,二氧化硫的含量很少,可直接排放到空气中 | |||
| D、阴极射线和α-粒子散射现象都对原子结构模型的建立做出了贡献 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、亚硫酸的酸性弱于氢硫酸 |
| B、亚硫酸溶液的酸性一定强于氢硫酸溶液 |
| C、氢硫酸的酸性弱于亚硫酸 |
| D、多元弱酸的酸性主要由第二步电离决定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2+2NaOH═Na2CO3+H2O |
| B、CuO+2HCl═CuCl2+H2O |
| C、CaCO3+2HCl═CaCl2+H2O+CO2↑ |
| D、2Na+2H2O═2NaOH+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、初始的速率甲、乙相同,生成二氧化碳的总量甲、乙也相同 |
| B、初始的速率甲大于乙,生成二氧化碳的总量也是甲大于乙 |
| C、初始的速率甲大于乙,生成二氧化碳的总量甲、乙相同 |
| D、反应速率和生成二氧化碳的总量均不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 4.0×74.5 |
| 1174 |
| A、①②③ | B、①②③④ |
| C、③④ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,当活泼金属转移2NA个电子时,可从盐酸中置换产生22.4LH2 |
| B、1mol氯气与足量的氢氧化钠反应,共转移了NA的电子 |
| C、标准状况下,2.24L甲烷和氨气的混合气中所含的电子数为NA |
| D、1mol/L的Na2S溶液中,含有的S2-的数目小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
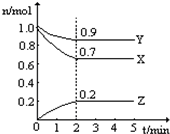 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com