
分析 A、用PH试纸检验溶液,发现溶液呈强酸性,则一定含H+,则一定不含CO32-;
B、取部分溶液逐滴加入NaOH溶液,使溶液由酸性变为碱性,无沉淀产生,则一定不含Mg2+;
C、取少量B中的碱性溶液,滴加Na2CO3溶液,有白色沉淀产生,则白色沉淀为碳酸钡,一定含Ba2+,则不含SO42-,以此来解答.
解答 解:A、用PH试纸检验溶液,发现溶液呈强酸性,则一定含H+,则一定不含CO32-;
B、取部分溶液逐滴加入NaOH溶液,使溶液由酸性变为碱性,无沉淀产生,则一定不含Mg2+;
C、取少量B中的碱性溶液,滴加Na2CO3溶液,有白色沉淀产生,则白色沉淀为碳酸钡,一定含Ba2+,则不含SO42-,由溶液显中性,可知一定含Cl-,
①综上所述,该溶液中肯定存在的离子有H+、Ba2+、Cl-,肯定不存在的离子有Mg2+、SO42-、CO32-,
故答案为:H+、Ba2+、Cl-;Mg2+、SO42-、CO32-;
②C中发生反应的离子方程式为Ba2++CO32-=BaCO3↓,故答案为:Ba2++CO32-=BaCO3↓.
点评 本题考查常见离子的推断,为高频考点,把握离子反应与现象为解答的关键,侧重分析与推断能力的考查,注意电荷守恒及离子共存的应用,题目难度不大.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 制备Fe(OH)3胶体 | 将NaOH浓溶液滴加到饱和FeCl3溶液中 |
| B | 由MgCl2溶液制备无水MgCl2 | 将MgCl2溶液加热蒸干 |
| C | 除去Cu粉中混有的CuO | 加入稀硝酸,过滤、洗涤、干燥 |
| D | 用CCl4萃取碘水中的I2 | 先从分液漏斗下口放出有机层,然后从上口倒出水层 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO32-、Cl-、OH- | B. | Cl-、OH-、CO32- | C. | OH-、Cl-、CO32- | D. | CO32-、OH-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三个反应均为放热反应,故不需要加热就能进行 | |
| B. | CO(g)+2H2(g)═CH3OH(g);△H>-90.5 kJ/mol | |
| C. | 甲醇的燃烧热为764 kJ/mol | |
| D. | 若CO的燃烧热为282.5 kJ/mol,则H2的燃烧热为286 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用已知浓度的NaOH溶液测定H2SO4溶液的浓度,所选用的滴定管如图甲、乙所示,从下表中选出正确选项( )
用已知浓度的NaOH溶液测定H2SO4溶液的浓度,所选用的滴定管如图甲、乙所示,从下表中选出正确选项( )| 锥形瓶中的溶液 | 滴定管中的溶液 | 选用指示剂 | 选用滴定管 | |
| A. | 碱 | 酸 | 石蕊 | 乙 |
| B. | 酸 | 碱 | 酚酞 | 甲 |
| C. | 碱 | 酸 | 甲基橙 | 乙 |
| D. | 酸 | 碱 | 酚酞 | 乙 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①③⑤⑥ | C. | ②③⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
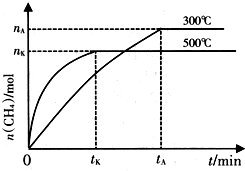 NH3和CO2是两种重要的化工原料.
NH3和CO2是两种重要的化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com