
 ,则下列说法正确的是( )
,则下列说法正确的是( )| A. | 发生水解反应时,被破坏的键是①和③ | |
| B. | 发生消去反应时,被破坏的键是①和④ | |
| C. | 发生水解反应时,被破坏的键是① | |
| D. | 发生消去反应时,被破坏的键是②和③ |
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:解答题
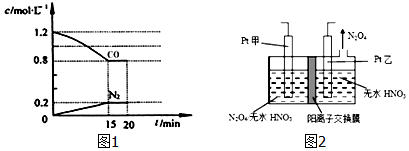
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 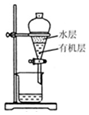 用如图装置分离有机 层与水层,水层从分液 漏斗下口放出 | |
| B. | 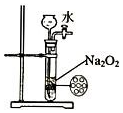 用如图装置可用来制 备少量氧气,并且控制 反应的发生与停止 | |
| C. | 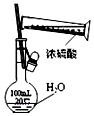 如图中配制一定物质的量浓度的硫酸溶液不能 直接在容量瓶中进行 | |
| D. | 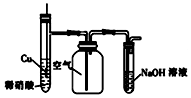 用如图装置制备并收集NO气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 1:3 | C. | 3:2 | D. | 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
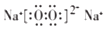 (用电子式表示).
(用电子式表示).查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | w=$\frac{36.5a}{(36.5a+22400)}$ | B. | w=$\frac{36.5c}{1000b}$ | ||
| C. | C=$\frac{1000ab}{(36.5a+22400)}$ | D. | b=$\frac{(36.5a+22400)}{(a+1)}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com