
10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50 ℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
甲同学认为:该溶液pH升高的原因是HCO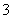 的水解程度增大,碱性增强。
的水解程度增大,碱性增强。
乙同学认为:该溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________NaHCO3的水解程度(填“大于”或“小于”)。
丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则________(填“甲”或“乙”)的判断正确。试剂X是________。
A.Ba(OH)2溶液 B.BaCl2溶液 C. NaOH溶液 D.澄清石灰水
(2)将加热煮沸后的溶液冷却到10 ℃,若溶液的pH________8.3(填“高于”、“低于”或“等于”),则甲判断正确。
(3)查阅资料,发现NaHCO3固体的分解温度为150 ℃,丙断言________(填“甲”或“乙”)判断是错误的,理由是_______________________________________________________________。
(4)关于NaHCO3饱和水溶液的表述正确的是_______________________。
a.c(Na+)=c(HCO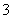 )+c(CO
)+c(CO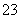 )+c(H2CO3)
)+c(H2CO3)
b.c(Na+)+c(H+)=c(HCO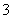 )+c(CO
)+c(CO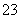 )+c(OH-)
)+c(OH-)
c.HCO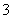 的电离程度大于HCO
的电离程度大于HCO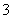 的水解程度
的水解程度
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下列离子能在溶液中大量共存的是( )
A.Na+、NH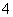 、CO
、CO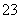 、Br-
、Br-
B.Fe2+、H+、NO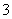 、Cl-
、Cl-
C.Al3+、Ca2+、HCO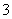 、SO
、SO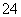
D.Fe3+、Cu2+、NO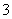 、OH-
、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态的三氧化二硼和液态水,放出649.5 kJ热量,其热化学方程式为______________________________________。
又已知:H2O(l)===H2O(g) ΔH=44 kJ·mol-1。则11.2 L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是__________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
双氧水(H2O2)和水都是极弱电解质,但H2O2比H2O更显酸性。
(1)若把H2O2看成是二元弱酸,请写出在水中的电离方程式:
________________________________________________________________________
________________________________________________________________________。
(2)鉴于H2O2显弱酸性,它能同强碱作用形成正盐,在一定条件下也可形成酸式盐。请写出H2O2与Ba(OH)2作用形成盐的化学方程式:
________________________________________________________________________
________________________________________________________________________。
(3)水电离生成H3O+和OH-叫作水的自偶电离。同水一样,H2O2也有极微弱的自偶电离,其自偶电离的方程式为_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定浓度的FeCl3溶液中,存在如下水解平衡:Fe3++3H2O Fe(OH)3+3H+,在此溶液中滴入饱和的FeCl3溶液,下列说法中正确的是( )
Fe(OH)3+3H+,在此溶液中滴入饱和的FeCl3溶液,下列说法中正确的是( )
A.水解平衡向正反应方向移动 B.水解平衡向逆反应方向移动
C.溶液中H+浓度不变 D.Fe3+的水解程度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
20℃时,两种一元弱酸的钠盐NaX和NaY,已知,往NaX溶液中通入CO2只能生成HX和NaHCO3;往NaY溶液中通入CO2能生成HY和Na2CO3,下列说法正确的是( )
A.酸性HY>HX B.结合H+的能力Y->CO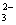 >X->HCO
>X->HCO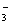
C.溶液的碱性:NaX>Na2CO3>NaY>NaHCO3 D.HX和HY酸性相同但比H2CO3弱
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)Fe2(SO4)3水溶液呈________性,原因是(用离子方程式表示) ;
实验室在配制Fe2 (SO4)3溶液时,需要加入________来抑制水解。
(2)泡沫灭火器中装有Al2(SO4)3溶液、NaHCO3溶液及起泡剂。写出使用时发生反应的离子方程式:_____________________________________________________。
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | C | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲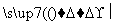 乙
乙 丙。下列有关物质的推断不正确的是( )
丙。下列有关物质的推断不正确的是( )
A.若甲为焦炭,则丁可能是O2
B.若甲为SO2,则丁可能是氨水
C.若甲为Fe,则丁可能是盐酸
D.若甲为NaOH溶液,则丁可能是CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示:已知A、B都为短周期元素,且甲、乙、丙常温下都为气体。2 mol甲分子反应生成1 mol 丙和3 mol乙,下列对此判断不正确的是(双选)( )
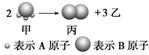
A.1个乙分子中含有2个A原子
B.甲的摩尔质量为17 g·mol-1
C.同温、同压下,生成丙和乙的体积比为3∶1
D.标准状况下,11.2 L甲溶于500 mL水中,所得溶液中甲的物质的量浓度为1 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com