
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加压 | B. | 加入NaF晶体 | C. | 通入SO2气体 | D. | 加入NaI晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 锌与硫酸铜溶液反应:Zn+Cu2+=Zn2++Cu | |
| C. | 碳酸钙与稀盐酸反应:CaCO3+2H +=Ca2++H2O+CO2↑ | |
| D. | 硫酸和氢氧化钡溶液反应:Ba2++SO42-+H++OH-=H2O+BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | n(B)/mol | n(C)/mol | n(D)/mol | 反应时间/min | 反应速率 |
| Ⅰ | 0.06 | 0.60 | 0.10 | t1 | v(正)=v(逆) |
| Ⅱ | 0.12 | 1.20 | 0.20 | t2 | |
| Ⅲ | 0.32 | 1.0 | 0 | 0 | |
| Ⅳ | 0.12 | 0.30 | v(正)=v(逆) |
| A. | 容器Ⅳ中c(D)=0.4 mol/L | |
| B. | t2时容器Ⅱ中v(正)>v(逆) | |
| C. | 容器Ⅰ中平均反应速率v(B)=$\frac{0.04}{{t}_{1}}$mol/(L•min) | |
| D. | 容器Ⅲ中反应至平衡时吸热20 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
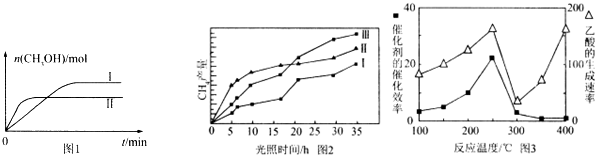 CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化见图1.
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化见图1.| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、b mol H2、 c mol CH3OH(g)、c mol H2O(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com