
| A. | X的氯化物与氨水反应可形成配合物[Zn(NH3)4]Cl2,1mol该配合物中含有12mol σ键 | |
| B. | Z的最高价含氧酸分子中,羟基氧和非羟基氧个数比为1:1 | |
| C. | Y的气态氢化物分子中H-Y-H键角比Y的最高价氧化物分子中O-Y-O键角小 | |
| D. | Z的气态氢化物比Y的气态氢化物稳定,是因为氢键的影响 |
分析 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2,电子排布为[Ar]3d104s2,X为Zn元素;元素Y基态原子的3p轨道上有4个电子,价电子排布为3s23p4,Y为S元素;元素Z基态原子的2p轨道上有3个未成对电子,价电子排布为2s22p3,为N元素,以此来解答.
解答 解:由上述分析可知,X为Zn,Y为S,Z为N,
A.Zn的氯化物与氨水反应可形成配合物[Zn(NH3)4]Cl2,锌离子与氨气分子之间形成4个配位键,氨气分子中N原子与H原子之间形成N-H价,故1mol该配合物中含有16mol σ键,故A错误;
B.Z的最高价含氧酸为HNO3,分子中羟基氧和非羟基氧个数比为1:2,故B错误;
C.H2S分子中硫原子价层电子对数为2+$\frac{6-1×2}{2}$=4,有2对孤电子对,VSEPR模型为正四面体,分子构型为V型结构,SO2分子中硫原子价层电子对数为2+$\frac{6-2×2}{2}$=3,有1对孤电子对,VSEPR模型为平面三角形,分子构型为V型结构,且硫化氢分子中孤电子对之间的排斥力大于孤电子对-成键电子对的排斥力,故S的气态氢化物分子中H-S-H键角比S的最高价氧化物分子中O-S-O键角小,故C正确;
D.Z的气态氢化物比Y的气态氢化物稳定,是因为N元素非金属性比硫的强,而氨气分子间含氢键,氢键使其沸点高,则稳定性与氢键无关,故D错误;
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子的电子排布、原子结构来推断元素为解答的关键,侧重分析与应用能力的考查,注意原子结构与性质的应用,题目难度不大.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
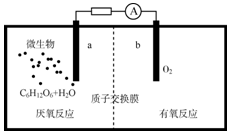
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的还原性:W>Y | |
| B. | 最高价氧化物对应的水化物的酸性:X>Z | |
| C. | W的阳离子和Z的阴离子均能促进水的电离 | |
| D. | 由W、Y、Z三种元素组成的化合物既含离子键又含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | X | R | T | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.078 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 | +5、-3 |
| A. | 简单氢化物的沸点:X>T>Q | |
| B. | 离子半径:X2->T2->L2+>M3+ | |
| C. | 工业上用电解熔融状态的L和T的化合物制取单质L | |
| D. | L、M的最高价氧化物对应的水化物既能与强碱反应又能与强酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 表中表示的一些物质或概念间的从属关系中不正确的是( )
表中表示的一些物质或概念间的从属关系中不正确的是( )| X | Y | Z | ||
| 例 | 氧化物 | 化合物 | 纯净物 | |
| A | 苯的同系物 | 芳香烃 | 芳香化合物 | |
| B | 烯烃 | 不饱和烃 | 烃 | |
| C | 氯乙烷 | 卤代烃 | 烃的衍生物 | |
| D | 羰基 | 羧基 | 酯基 | |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤、石油、天然气均为混合物,煤中含有苯等有机物 | |
| B. | 石油裂化和煤的干馏都是化学变化,而石油的分馏和煤的气化都是物理变化 | |
| C. | 石油的裂解主要目的是提高汽油的产量和质量 | |
| D. | 汽油燃烧产生的汽车尾气中,所含的大气污染物主要是碳氮的氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
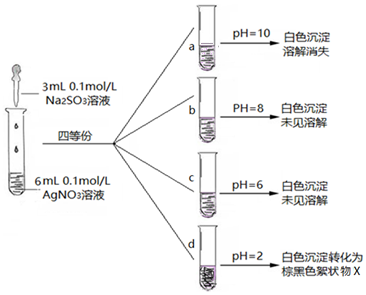
| 实验 | 操作 | 现象 |
| ⅰ | 将其置于试管中加稀盐酸、观察 | 无明显现象 |
| ⅱ | 将其置于试管中加足量浓硝酸、观察 | 立即产生红棕色气体 |
| ⅲ | 在ⅱ反应所得溶液中,加Ba(NO3)2溶液、观察,再加BaCl2、观察 | 前者无明显现象,后者出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

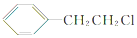 ,B的名称为苯乙烯.
,B的名称为苯乙烯.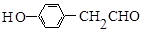 .
.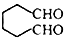 (1,6-己二醛)的合成路线.
(1,6-己二醛)的合成路线.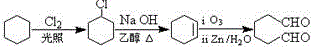
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com