
| A. | 取少许某溶液,滴加数滴KSCN溶液,无明显现象;再另取少许原溶液,先滴少量新制氯水,再滴加数滴KSCN溶液,溶液变血红色,则原溶液中一定含Fe2+ | |
| B. | 焰色反应时,用稀硫酸洗净铂丝,并在火焰上灼烧至无色,然后蘸取溶液 | |
| C. | 在淀粉溶液中加入稀硫酸并加热片刻后,再加入适量银氨溶液,水浴加热后没有银镜生成,说明淀粉没有水解 | |
| D. | 测定某溶液的pH,常用干燥洁净的玻璃棒蘸取该溶液滴在润湿的pH试纸上 |
分析 A.铁离子和KSCN溶液反应生成络合物而使溶液呈血红色,亚铁离子和KSCN溶液不反应,氯气具有强氧化性,能氧化亚铁离子而生成铁离子;
B.焰色反应洗涤铂丝时用稀盐酸而不是稀硫酸;
C.银镜反应必须在碱性条件下;
D.测定溶液的pH值时不能用湿润的pH试纸,应该用干燥的pH试纸.
解答 解:A.铁离子和KSCN溶液反应生成络合物而使溶液呈血红色,亚铁离子和KSCN溶液不反应,氯气具有强氧化性,能氧化亚铁离子而生成铁离子,取少许某溶液,滴加数滴KSCN溶液,无明显现象,说明溶液中不含铁离子;再另取少许原溶液,先滴少量新制氯水,再滴加数滴KSCN溶液,溶液变血红色,则原溶液中一定含Fe2+,故A正确;
B.焰色反应洗涤铂丝时用稀盐酸而不是稀硫酸,因为硫酸盐熔点较高,而氯化物熔点较低,在灼烧铂丝时能挥发而排除干扰,故B错误;
C.银镜反应必须在碱性条件下,所以在加入银氨溶液之前必须加入NaOH中和未反应的稀硫酸,否则影响葡萄糖的检验,故C错误;
D.测定溶液的pH值时不能用湿润的pH试纸,应该用干燥的pH试纸,否则导致测定溶液浓度降低,溶液的pH值可能改变,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及离子检验、焰色反应、银镜反应、pH值测定等知识点,明确实验原理、元素化合物性质、实验基本操作是解本题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
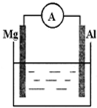 如图所示装置:
如图所示装置:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH和Na2CO3与CH3COOH和NaHCO3 | |
| B. | AgNO3和HCl与AgNO3和NaCl | |
| C. | BaCl2和Na2SO4 与Ba(OH)2和H2SO4 | |
| D. | KOH和AlCl3与氨水和AlBr3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.26mol | B. | 0.28 mol | C. | 0.30 mol | D. | 0.32 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O+H2O?H3O++OH- | B. | CO32-+H2O?HCO3-+OH- | ||
| C. | CO2+H2O?H2CO3 | D. | HCO3-+H2O?CO32-+H3+O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将100 mL 0.1 mol•L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒数目为0.01NA | |
| B. | Na2O2与足量的水反应生成1 mol O2,转移电子数目为2NA | |
| C. | 某密闭容器中有2 mol SO2和1 mol O2,在一定条件下充分反应,转移的电子数为4NA | |
| D. | 18 g重水(D2O)所含的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
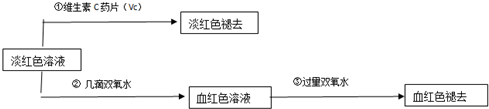
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com