
分析 (1)根据烃燃烧的通式CnHm+(n+$\frac{m}{4}$)O2→nCO2+$\frac{m}{2}$H2O可知,在等物质的量条件下,(n+$\frac{m}{4}$)越大,消耗的氧气越多;
(2)在质量相等时分子组成中含氢量越高,生成的水越多;等质量的烃完全燃烧,H元素质量分数越大,耗氧量越大.
解答 解:(1)根据烃燃烧的通式CnHm+(n+$\frac{m}{4}$)O2→nCO2+$\frac{m}{2}$H2O可知,在等物质的量条件下,(n+$\frac{m}{4}$)越大,消耗的氧气越多,所以消耗氧气的量最多的是C6H6,故答案为:C6H6;
(2)等质量的以上三种物质完全燃烧时,CH4中H元素质量分数大于C2H4、苯中H元素质量分数,故等质量的有机物完全燃烧,CH4耗氧量较大,生成水最多的也是CH4
故答案为:CH4;CH4.
点评 本题考查有机物燃烧有关计算,难度不大,注意根据燃烧通式及元素质量分数理解烃耗氧量.


科目:高中化学 来源: 题型:选择题
| A. | 把金属铁放入稀硫酸中 2Fe+6H+=2Fe3++3H2↑ | |
| B. | 向Ca(ClO)2溶液中通入二氧化硫 Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO | |
| C. | 向Ca(HCO3)2溶液中加入足量的氢氧化钠溶液 Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| D. | 向NH4HSO4稀溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全:NH4++H++SO42-+Ba2++2OH-=NH3•H2O+BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HNO3、FeSO4;Fe2(SO4)3、Fe(NO3)3、N2O | B. | Fe2(SO4)3、N2O;FeSO4、HNO3、Fe(NO3)3 | ||
| C. | HNO3、Fe2(SO4)3;FeSO4、Fe(NO3)3、N2O | D. | FeSO4、Fe(NO3)3;Fe2(SO4)3、HNO3、N2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
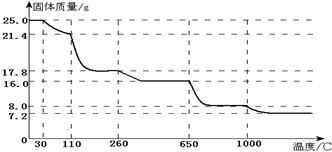
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
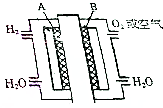 为体现“绿色奥运”“科技奥运”,2008年北京奥运会出现了中国自己生产的燃料电池汽车,它是以铂作电极,硫酸溶液作电解液,其工作原理如图所示;
为体现“绿色奥运”“科技奥运”,2008年北京奥运会出现了中国自己生产的燃料电池汽车,它是以铂作电极,硫酸溶液作电解液,其工作原理如图所示;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10℃时,0.1mol/L Na2S2O3和0.1mol/L H2SO4各5mL | |
| B. | 20℃时,0.1mol/L Na2S2O3和0.1mol/L H2SO4各5mL | |
| C. | 10℃时,0.1mol/L Na2S2O3和0.1mol/L H2SO4各5mL,加水10mL | |
| D. | 20℃时,0.2mol/L Na2S2O3和0.1mol/L H2SO4各5mL,加水10mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
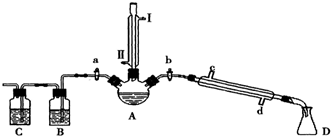
| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com