
分析 (1)根据v(H2)=$\frac{3}{2}$c(NH3)进行计算;
(2)化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比,反应N2(g)+3H2(g)?2NH3(g )△H<0正反应为放热反应;
(3)根据反应的可逆性特点以及温度改变平衡一定发生移动进行判断;
(4)体积减小,气体压强增大,平衡向气体体积减小的方向移动,化学平衡常数只与温度有关,温度不变,化学平衡常数不变;
(5)第5分钟末将容器的体积缩小一半后,压强增大,平衡正向移动,氨气的浓度增大,在第8分钟末达到新的平衡时NH3的浓度约为0.25mol•L-1;
(6)A.增大压强平衡右移;
B.压强不同,平衡状态不同;
C.升高温度平衡逆向移动;
D.催化剂不影响平衡移动.
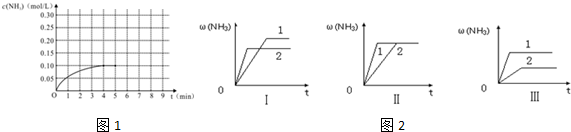
解答 解:(1)根据图象分析平衡时氨气的浓度为0.1mol/L,时间为4min,所以依据速率之比等于系数之比得到:v(H2)=$\frac{3}{2}$v(NH3)=$\frac{3}{2}$×$\frac{0.1mol/L}{4min}$=0.0375 mol/(L•min),故答案为:0.0375 mol/(L•min);
(2)该反应的化学平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$,反应N2(g)+3H2(g)?2NH3(g )△H<0正反应为放热反应,随温度的升高,平衡逆向移动,平衡常数减小,故答案为:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$;减小;
(3)该反应为可逆反应,反应物不可能完全转化,则NH3的物质的量浓度不可能为0.2mol/L,温度改变平衡一定发生移动,则NH3的物质的量浓度不可能为0.1mol/L,故答案为:a、c;
(4)该反应是气体体积减小的反应,把容器的体积缩小一半,增大了反应体系的压强,增大压强,平衡向气体体积减小的方向移动,即向正反应方向移动;化学平衡常数只与温度有关,温度不变,平衡常数不变,
故答案为:向正反应方向;不变;
(5)第5分钟末将容器的体积缩小一半后,氨气浓度为0.40mol/L,压强增大,平衡正向移动,氨气的浓度增大,在第8分钟末达到新的平衡时NH3的浓度约为0.50mol•L-1,则图象为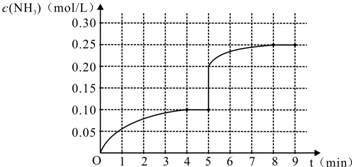 ,故答案为:
,故答案为: ;
;
(6)A.增大压强平衡右移,氨气的含量应增大,故A错误;
B.压强不同,平衡状态不同,不可能在同一平衡状态,故B错误;
C.升高温度平衡逆向移动,氨气的含量减小,故C错误;
D.催化剂不影响平衡移动,由图象可知催化剂性能,1>2,故D正确.
故答案为:D.
点评 本题考查化学平衡的计算,明确反应速率计算、平衡的影响因素及图象的分析试剂解答本题的关键,题目难度中等,难点是(5)题图象,注意缩小体积瞬间,氨气浓度变为原来的2倍,为易错点.


 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源:2016-2017学年山东省高一上10月月考化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.石灰石与盐酸反应:CO32- +2H+==H2O+CO2↑
B.醋酸与烧碱溶液反应: H++OH-==H2O
C.MgSO4溶液与Ba(OH)2溶液反应:SO42-+Ba2+= BaSO4↓
D.硫酸与氨水混合: H++NH3·H2O==NH4++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3(Al2O3)用盐酸 | B. | Fe2O3(Al2O3)用氨水 | ||
| C. | Mg(Al)用纯碱溶液 | D. | MgCl2(AlCl3)用氢氧化钠溶液和盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
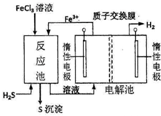 现代工业生产中常用电解氯化亚铁的方法制得氯化铁溶液吸收有毒的硫化氢气体.工艺原理如图所示.下列说法中不正确的是( )
现代工业生产中常用电解氯化亚铁的方法制得氯化铁溶液吸收有毒的硫化氢气体.工艺原理如图所示.下列说法中不正确的是( )| A. | 左槽中发生的反应是:2Cl--2e-═Cl2↑ | |
| B. | 右槽中的反应式:2H++2 e-═H2↑ | |
| C. | H+从电解池左槽迁移到右槽 | |
| D. | FeCl3溶液可以循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| V(Na2S2O3)/mL | 21.90 | 18.80 | 22.10 | 22.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
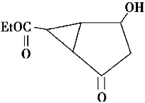 及其核磁共振氢谱图如下:下列关于该有机物的叙述正确的是( )
及其核磁共振氢谱图如下:下列关于该有机物的叙述正确的是( )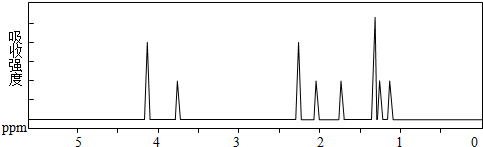
| A. | 该有机物不同化学环境的氢原子有6种 | |
| B. | 该有机物属于芳香族化合物 | |
| C. | 键线式中的Et代表的基团为-CH3 | |
| D. | 该有机物的分子式为C9H12O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
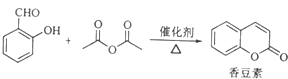
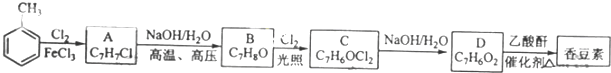
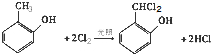 ;
;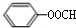 (写结构简式)
(写结构简式)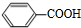 (写结构简式)
(写结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
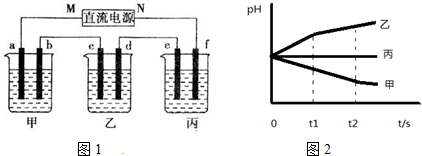
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
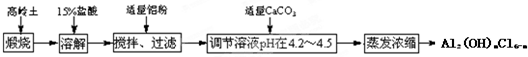
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com