
| A. | 加热分解NH4HCO3 | B. | 加热NaHCO3 | C. | 熔化烧碱 | D. | 加热NaCl |
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 降低温度 | C. | 通入氦气 | D. | 加入催化剂 | ||||
| E. | 移出氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
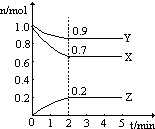 某温度时,图中曲线X,Y,Z是在2L容器中X,Y,Z三种物质的物质的量随时间的变化曲线.由图中数据分析,该反应的化学方程3X+Y=2Z;反应从开始计时,
某温度时,图中曲线X,Y,Z是在2L容器中X,Y,Z三种物质的物质的量随时间的变化曲线.由图中数据分析,该反应的化学方程3X+Y=2Z;反应从开始计时,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+ Ba2+ Cl- CO32- | B. | ClO- SO42- Fe2+ H+ | ||
| C. | K+ Na+ SO42- MnO4- | D. | Na+ H+ NO3-HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
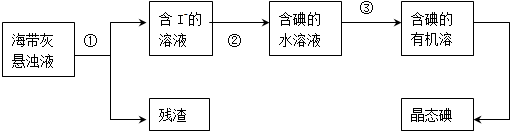
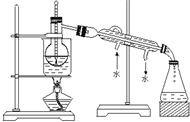
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
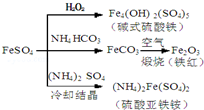
| A. | 碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂 | |
| B. | 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行 | |
| C. | 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化 | |
| D. | 常温下,(NH4)2Fe(SO4)2比FeSO4易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

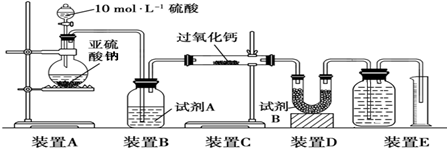
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1LCO2中含有3NA个原子 | |
| B. | 1molCl2含有1NA个原子 | |
| C. | 23g钠在足量的Cl2中反应,转移电子数NA个 | |
| D. | 欲配制1.00L1.00mol•L-1的NaCl溶液,可将58.5gNaCl溶于1.00L水中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com