
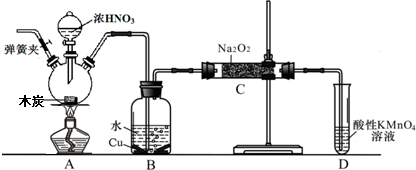
| ||
| ||
| ||
| ||
| 4 |
| 3 |
| 8 |
| 3 |
| 2 |
| 3 |
| 4 |
| 3 |
| 2 |
| 3 |
| 1.56g |
| 78g/mol |


科目:高中化学 来源: 题型:
| A、20℃时18g水 |
| B、标准状况下含6.02×1023个原子的Cl2 |
| C、常温常压下1mol氨 |
| D、标准状况下44g二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||||||||
| B、1 mol CH4与1 mol NH4+所含质子数相等 | ||||||||
| C、等物质的量的甲基(-CH3)与羟基(-OH)所含电子数相等 | ||||||||
| D、二氧化硫溶于水所得的溶液可导电,说明二氧化硫是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
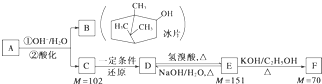
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、粗盐提纯时,为了加快过滤速率,可用玻璃棒搅拌漏斗中的液体 |
| B、分液操作中,将下层液体放入一烧杯后,再将上层液体继续放入另一烧杯中 |
| C、蒸发KNO3溶液时,当蒸发皿中出现大量晶体时即停止加热,用余热蒸干剩余的水分,获取KNO3晶体 |
| D、蒸馏操作中,温度计水银球部位要插入液面下且不接触蒸馏烧瓶壁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com