
| 容器 | 物质 | 起始浓度/(mol•L-1) | 平衡浓度/(mol•L-1) |
| Ⅰ | N2O4 | 0.100 | 0.040 |
| NO2 | 0 | 0.120 | |
| Ⅱ | N2O4 | 0 | 0.014 |
| NO2 | 0.100 | 0.072 |
| A. | 平衡时,Ⅰ、Ⅱ中反应物的转化率α(N2O4)<α(NO2) | |
| B. | 平衡时,升高温度,Ⅰ中速率减慢,Ⅱ中速率加快 | |
| C. | 当密度不变时,上述反应即达平衡 | |
| D. | 平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深 |
分析 A.转化率=$\frac{浓度变化量}{起始浓度}$×100%,据此计算转化率进行判断;
B.升高温度,反应速率加快;
C.混合气体总质量不变,容器容积不变,容器内气体的密度为定值;
D.升高温度平衡向吸热反应进行,容器I、Ⅱ中NO2浓度均增大.
解答 解:A.Ⅰ中α(N2O4)=(0.1-0.04)mol/L÷0.1mol/L=0.6,Ⅱ中α(NO2)=(0.1-0.072)mol/L÷0.1mol/L=0.28,故Ⅰ、Ⅱ中反应物的转化率α(N2O4)>α(NO2),故A错误;
B.升高温度,Ⅰ、Ⅱ中反应速率均加快,故B错误;
C.混合气体总质量不变,容器容积不变,容器内气体的密度为定值,则密度不变不能说明反应到达平衡,故C错误;
D.2NO2(g)?N2O4(g)△H<0,升高温度,平衡向生成NO2的方向移动,NO2浓度增大,颜色均变深,故D正确,
故选:D.
点评 本题考查化学平衡计算与影响因素、反应速率影响因素、平衡状态判断,难度不大,注意对基础知识的理解掌握.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 氧化剂H2O2被称为绿色氧化剂,因而受到人们越来越多的关注,某实验小组以过氧化氢分解为例,探究浓度、溶液的酸碱性对反应速率的影响.在常温下按照下表完成实验.
氧化剂H2O2被称为绿色氧化剂,因而受到人们越来越多的关注,某实验小组以过氧化氢分解为例,探究浓度、溶液的酸碱性对反应速率的影响.在常温下按照下表完成实验.| 实验编号 | 反应物 |
| a | 10mL2%H2O2溶液、少量烧碱 |
| b | 10mL2%H2O2溶液 |
| c | 10mL2%H2O2溶液、少量盐酸 |
| d | 10mL5%H2O2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
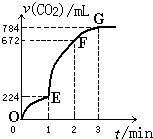 常温下,用纯净的CaCO3与100mL稀盐酸制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况).
常温下,用纯净的CaCO3与100mL稀盐酸制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HOCH2CH2COOCH2CH3 | B. | HOCH2CH2CH2CH2COOH | ||
| C. | CH3CH2CH(OH)CH2COOH | D. | CH3CH(OH)CH2CH2COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2012年10月1日起,我国将逐步淘汰白炽灯而采用高效照明的电致发光产品,电致发光材料有掺杂Mn2+和Cu2+的硫化锌、蒽单晶、8一羟基喹啉铝等.
2012年10月1日起,我国将逐步淘汰白炽灯而采用高效照明的电致发光产品,电致发光材料有掺杂Mn2+和Cu2+的硫化锌、蒽单晶、8一羟基喹啉铝等.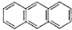 ,平面结构)属于非极性(填“极性”或“非极性”)分子.
,平面结构)属于非极性(填“极性”或“非极性”)分子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L水含有0.1NA个水分子 | |
| B. | 0.3molSO2中含有的氧原子数为0.3NA | |
| C. | 标准状况下,22.4L氖气含有2NA个原子 | |
| D. | 1L 0.1mol/LMgCl2溶液中含Cl-数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn与稀H2SO4反应:Zn+2H+═Zn2++H2↑ | |
| B. | 铁和稀硝酸反应:Fe+2H+═Fe2++H2↑ | |
| C. | Cl2与NaOH溶液反应:Cl2+2OH-═2Cl-+H2O | |
| D. | 碳酸钙溶于盐酸:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com