
| 温度/℃ | 压强/kPa | Z的质量分数 |
| 200 | 101 | 0.40 |
| 300 | 101 | 0.48 |
| 400 | 202 | 0.52 |
| 400 | 303 | 0.52 |
| A. | 3X(g)+Y(g)?3Z(g)△H>0 | B. | X(g)+3Y(g)?4Z(g)△H<0 | C. | 3X(g)+Y(g)?4Z(g)△H>0 | D. | X(g)+3Y(g)?3Z(g)△H<0 |
分析 由表中数据可知,压强一定时,温度越高Z的质量分数越大,说明升高温度平衡向正反应方向移动,正反应为吸热反应;温度一定时,压强越大Z的质量分数不变,说明增大压强平衡不移动,则反应前后气体的总化学计量数不变,以此来解答.
解答 解:由表中数据可知,压强一定时,温度越高Z的质量分数越大,说明升高温度平衡向正反应方向移动,正反应为△H>0;温度一定时,压强越大Z的质量分数不变,说明增大压强平衡不移动,则反应前后气体的总化学计量数不变,则
A.3+1≠3,不符合增大压强,Z的质量分数不变,故A不选;
B.△H<0,不符合升高温度,Z的质量分数增大,故B不选;
C.3+1=4,符合增大压强,Z的质量分数不变,且△H>0符合升高温度,Z的质量分数增大,故C选;
D.3+1≠3,不符合增大压强,Z的质量分数不变,.△H<0,不符合升高温度,Z的质量分数增大,故D不选;
故选C.
点评 本题考查化学平衡图象与平衡移动因素,为高频考点,注意利用控制变量法分析表中数据判断温度、压强对平衡的影响为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案科目:高中化学 来源: 题型:多选题
| A. | CH3COOH溶液中离子浓度的关系满足:c(H+)>c(CH3COO-) | |
| B. | CH3COOH溶液中加入少量CH3COONa固体,平衡逆向移动 | |
| C. | 0.1mol/L的CH3COOH溶液加水稀释,溶液中的离子浓度均减小 | |
| D. | 常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 甲 | 乙 | 丙 | 丁 | 戊 |
| A:D=2:1 | B:D=1:2 | E:C=3:2 | E:F=1:2 | B:F=1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
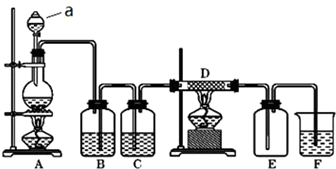

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学键 | C≡O | H-O | H-H | C═O |
| E/(kJ.mol-1) | a | b | c | d |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
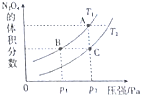
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| X | Y | ||
| W | Z |
| A. | X、Y、Z三种元素气态氢化物的沸点依次升高 | |
| B. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| C. | W、X、Z三种元素最高价氧化物对应的水化物的酸性依次增强 | |
| D. | W、X、Z三种元素最高正化合价依次升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
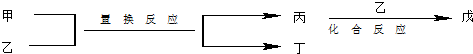
| 选项 | 甲 | 乙 | 丙 | 丁 | 戊 |
| NH3 | O2 | NO | H2O | NO2 | |
| Mg | CO2 | C | MgO | CO | |
| C | H2O | CO | H2 | CO2 | |
| FeBr2 | Cl2 | FeCl2 | Br2 | FeCl3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将乙酸和乙醇的混合物注入浓硫酸中制备乙酸乙酯 | |
| B. | 将铜丝在酒精灯的外焰上加热变黑后,插入乙醇溶液中铜丝又恢复到原来的红色 | |
| C. | 往试管中注入2mLCuSO4溶液,再滴几滴NaOH溶液后,加入乙醛溶液即有红色沉淀产生 | |
| D. | 向淀粉溶液中加入稀硫酸加热,一段时间后,再加入银氨溶液检验是否水解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com