
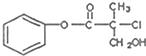
| A. | 该有机物可以在一定条件下与HBr发生反应 | |
| B. | 1mol该有机物最多能与4molH2发生加成反应 | |
| C. | 该有机物在一定条件下可以发生消去反应 | |
| D. | 1mol该有机物一足量的NaOH溶液反应,最多可以消耗3molNaOH |
分析 有机物含有酯基,可发生水解反应,含有氯原子,可发生水解、消去反应,含有羟基,可发生取代、氧化反应,以此解答该题.
解答 解:A.含有羟基,在一定条件下可被HBr取代,故A正确;
B.只有苯环与氢气发生加成反应,则1mol该有机物最多能与3molH2发生加成反应,故B错误;
C.含有氯原子,且邻位碳原子有氢原子,可发生消去反应,故C正确;
D.能与氢氧化钠反应的官能团为酯基和氯原子,且酯基可水解生成酚羟基,最多可以消耗3molNaOH,故D正确.
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重有机物性质及分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | A3BC4 | B. | A2(BC4)3 | C. | A2BC3 | D. | A2BC4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
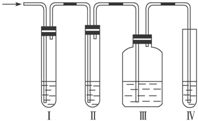 (1)在实验室里制取乙烯常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计如图所示实验以确认上述混和气体中有C2H4和SO2. (乙烯的制取装置略)
(1)在实验室里制取乙烯常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计如图所示实验以确认上述混和气体中有C2H4和SO2. (乙烯的制取装置略)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
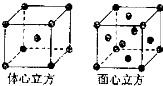 Mn、Fe均为第四周期过渡元素.请回答下列问题:
Mn、Fe均为第四周期过渡元素.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| B. | 氯化亚铁溶液和稀硝酸混合:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ | |
| C. | AlCl3溶液中加入足量的氨水:Al3++4OH-═AlO2-+2H2O | |
| D. | NO2溶于水:3NO2+H2O═2H++2NO3-+NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光纤的主要成分是高纯度的单质硅 | |
| B. | SiO2是酸性氧化物,它不溶于水也不溶于任何酸 | |
| C. | 因高温时SiO2与Na2CO3反应放出CO2,所以H2SiO3酸性比H2CO3强 | |
| D. | 28Si、29Si、30Si互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ④⑤⑥⑦ | C. | ①②③⑤⑦⑧ | D. | ①②⑤⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com