
 ÓŠŅ»ĪŽÉ«ĶøĆ÷ČÜŅŗ£¬æÉÄÜŗ¬Al3+”¢Fe3+”¢Mg2+”¢Na+”¢CO32-”¢Cl-”¢NO3-µČĄė×ÓÖŠµÄČōøÉÖÖ£®ĻÖ×öČēĻĀŹµŃé£ŗ
ÓŠŅ»ĪŽÉ«ĶøĆ÷ČÜŅŗ£¬æÉÄÜŗ¬Al3+”¢Fe3+”¢Mg2+”¢Na+”¢CO32-”¢Cl-”¢NO3-µČĄė×ÓÖŠµÄČōøÉÖÖ£®ĻÖ×öČēĻĀŹµŃé£ŗ


| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| A”¢1 mol?L-1 NaClČÜŅŗŗ¬ÓŠNAøöNa+ |
| B”¢±ź×¼×“æöĻĀ£¬·Ö×ÓŹżĪŖNAµÄCO”¢N2µÄ»ģŗĻĘųĢåĢå»żŌ¼ĪŖ22.4 L£¬ÖŹĮæĪŖ28 g |
| C”¢±ź×¼×“æöĻĀ£¬22.4 LæÕĘųŗ¬ÓŠNAøöµ„ÖŹ·Ö×Ó |
| D”¢22.4 L O2Ėłŗ¬µÄŌ×ÓŹżĪŖ2NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
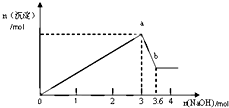
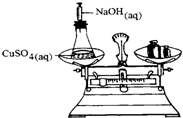 ½«Ņ»ĆܱյĻÆѧ·“ӦװÖĆŌŚĢģĘ½ÉĻ³ĘĮæ£ØČēĶ¼ĖłŹ¾£©£®µ±ŌŚČÜŅŗ֊עČėĒāŃõ»ÆÄĘČÜŅŗÖ®ŗó£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ£Ø””””£©
½«Ņ»ĆܱյĻÆѧ·“ӦװÖĆŌŚĢģĘ½ÉĻ³ĘĮæ£ØČēĶ¼ĖłŹ¾£©£®µ±ŌŚČÜŅŗ֊עČėĒāŃõ»ÆÄĘČÜŅŗÖ®ŗó£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ£Ø””””£©| A”¢»įÓŠ³Įµķ²śÉś£¬ĢģĘ½×óÅĢÖŹĮæŌö¼Ó |
| B”¢ÓŠĘųĢå²śÉś£¬ĢģĘ½×óÅĢÖŹĮæ¼õÉŁ |
| C”¢“ĖŹµŃéæÉÓĆÓŚĖµĆ÷»Æѧ·“Ó¦µÄÖŹĮæŹŲŗć |
| D”¢±¾·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗCuSO4+2OH-ØTCu£ØOH£©2”ż+SO42- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| A”¢ŌŚŅ»¶ØĪĀ¶ČĻĀAgClĖ®ČÜŅŗÖŠ£¬Ag+ŗĶCl-ÅØ¶ČµÄ³Ė»żŹĒŅ»øö³£Źż |
| B”¢ĪĀ¶ČŅ»¶ØŹ±£¬µ±ČÜŅŗÖŠAg+ŗĶCl-ÅØ¶ČµÄ³Ė»żµČÓŚKspÖµŹ±£¬“ĖČÜŅŗĪŖAgClµÄ±„ŗĶČÜŅŗ |
| C”¢AgClµÄKsp=1.8”Į10-10 mol2?L-2£¬ŌŚČĪŗĪŗ¬AgCl¹ĢĢåµÄČÜŅŗÖŠ£¬c£ØAg+£©=c£ØCl-£©ĒŅAg+ÓėCl-ÅØ¶ČµÄ³Ė»żµČÓŚ1.8”Į10-10 mol2?L-2 |
| D”¢Ļņ±„ŗĶAgClĖ®ČÜŅŗÖŠ¼ÓČėŃĪĖį£¬KspÖµ±ä“ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| A”¢ĖłµĆČÜŅŗÖŠµÄc£ØH+£©=1.0”Į10-13mol?L-1 |
| B”¢ĖłµĆČÜŅŗÖŠÓÉĖ®µēĄė²śÉśµÄc£ØOH-£©=1.0”Į10-13 mol?L-1 |
| C”¢ĖłµĆČÜŅŗÖŠµÄc£ØMg2+£©=5.6”Į10-10 mol?L-1 |
| D”¢298KŹ±£¬±„ŗĶMg£ØOH£©2µÄČÜŅŗÓė±„ŗĶMgF2ČÜŅŗĻą±ČĒ°ÕßµÄc£ØMg2+£©“ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| A”¢25”ę”¢101kPa ĻĀ£¬Na2O2£Øs£©+2 Na£Øs£©=2Na2O£Øs£©”÷H=-317kJ/mol |
| B”¢¢ŁŗĶ¢ŚÉś³ÉµČĪļÖŹµÄĮæµÄ²śĪļ£¬×ŖŅʵē×ÓŹż²»Ķ¬ |
| C”¢³£ĪĀĻĀNaÓė×ćĮæO2·“Ӧɜ³ÉNa2O£¬ĖęĪĀ¶ČÉżøßÉś³ÉNa2OµÄĖŁĀŹÖš½„¼Óæģ |
| D”¢¢ŁŗĶ¢Ś²śĪļµÄŅõŃōĄė×ÓøöŹż±Č²»ĻąµČ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| A”¢ÅØĻõĖįŗĶĀČĖ®ÓĆ×ŲÉ«ŹŌ¼ĮĘæ±£“ę |
| B”¢Įņ»ÆÄĘŗĶŃĒĮņĖįÄĘ¹ĢĢå³¤ĘŚ±©Ā¶ŌŚæÕĘųÖŠ±äÖŹ |
| C”¢³£ĪĀĻĀĢśŗĶ²¬¶¼²»ČÜÓŚÅØĻõĖį |
| D”¢SO2ŗĶNa2SO3ČÜŅŗ¶¼ÄÜŹ¹ĀČĖ®ĶŹÉ« |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com