
【题目】(一)W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为_______。
(2)W与Y可形成化合物W2Y,该化合物的电子式为____。
(二)A、B、C、D均为中学化学常见的纯净物,A是单质。
它们之间有如下的反应关系:

(3)若A是淡黄色固体,C、D是氧化物,且C是造成酸雨的主要物质。则C与另一种淡黄色物质反应的化学方程式_____。
(4)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。判断单质A的元素在周期表中的位置是_____。
(5)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写该反应的离子方程式_____。
【答案】Al(OH)3+OH-=AlO2-+2H2O 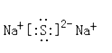 SO2+Na2O2=Na2SO4 第三周期ⅢA族 Cu+2Fe3+=Cu2++2Fe2+
SO2+Na2O2=Na2SO4 第三周期ⅢA族 Cu+2Fe3+=Cu2++2Fe2+
【解析】
(一)
W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,其最高价氧化物对应的水化物为碱,且两种碱可以反应生成盐和水,则W为Na元素,X为Al元素,Y、Z是非金属元素,W为Na,W可以和Y形成,则Y为-2价,为ⅥA元素,且和钠同周期,所以为S,Y的低价氧化物为;并且Z和Y同周期,原子序数比Y大,所以Y为Cl,根据元素所在周期表中的位置结合元素周期律的递变规律解答该题。
(二)
(1)C是造成酸雨的主要物质则C是SO2,A是淡黄色固体,则A是S,所以SO2与另一淡黄色固体过氧化钠反应;
(2)D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体,则D是Al(OH)3,C是NaAlO2,则A是Al,B是Al2O3;
(3)A是应用最广泛的金属,④反应用到A,则A为Fe,C的溶液用于蚀刻印刷铜电路板,C是FeCl3,②⑤反应用到的非金属为Cl2,所以D是FeCl2,以此来解答;
(一)
(1)W、X为金属,其最高价氧化物对应的水化物为碱,且两种碱可以反应生成盐和水,则为NaOH和Al(OH)3,二者反应的离子方程式: Al(OH)3+OH-=AlO2-+2H2O;
(2)W为Na,W可以和Y形成W2Y,则Y为-2价,为ⅥA元素,且和钠同周期,所以为S,W2Y为Na2S,电子式为:![]() ;
;
(二)
(1)C是造成酸雨的主要物质则C是SO2,A是淡黄色固体,则A是S,所以SO2与另一淡黄色固体过氧化钠反应,反应方程式为Na2O2+SO2=Na2SO4;
(2)D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体,则D是Al(OH)3,C是NaAlO2,则A是Al,B是Al2O3,所以A在元素周期表的位置为第三周期ⅢA族;
(3)A是应用最广泛的金属,④反应用到A,则A为Fe,C的溶液用于蚀刻印刷铜电路板,C是FeCl3,②⑤反应用到的非金属为Cl2,所以D是FeCl2,反应方程式为Cu+2Fe3+=Cu2++2Fe2+;


科目:高中化学 来源: 题型:
【题目】在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要村料。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是____________(填标号)。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是__________、__________。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是__________,其中与乙二胺形成的化合物稳定性相对较高的是__________(填“Mg2+”或“Cu2+”)。
(3)一些氧化物的熔点如下表所示:
氧化物 | Li2O | MgO | P4O6 | SO2 |
熔点/°C | 1570 | 2800 | 23.8 | 75.5 |
解释表中氧化物之间熔点差异的原因__________。
(4)图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x=__________pm,Mg原子之间最短距离y=__________pm。设阿伏加德罗常数的值为NA,则MgCu2的密度是__________g·cm3(列出计算表达式)。


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钇的常见化合价为+3价,我国蕴藏着丰富的含钇矿石(Y2FeBe2Si2O10),工业上通过如下生产流程可获得氧化钇。
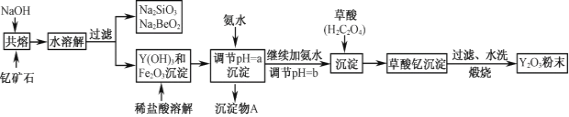
已知:①该流程中有关金属离子形成氢氧化物沉淀时的pH见下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe3+ | 2.1 | 3.1 |
Y3+ | 6.0 | 8.2 |
②在元素周期表中,铍元素和铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
(1)写出Na2SiO3的一种用途________________________。
(2)若改用氧化物的形式表示Y2FeBe2Si2O10组成,则化学式为__________。
(3)根据元素周期表的知识判断,常温下,氯化锶溶液pH____7(填“大于”、“等于”或“小于”);写出氯化锶的电子式:______________________。
(4)欲从Na2SiO3和Na2BeO2混合溶液中制得Be(OH)2沉淀。
① 最好选用盐酸和_______两种试剂,再通过必要的操作即可实现。
A.NaOH溶液 B.氨水 C.CO2 D.HNO3
② 写出Na2BeO2与足量盐酸发生反应的离子方程式___________________________。
(5)为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在_________范围内;继续加氨水调节pH =b发生反应的离子方程式为____________________________;检验Fe3+是否沉淀完全的操作方法是:___________________________________。
(6)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3·nH2O]煅烧的化学方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置完成对应的实验,能达到实验目的的是
A. 制取并收集少量乙炔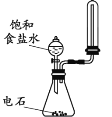
B. 制取并检验乙烯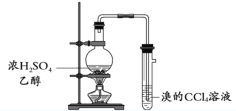
C. 检验溴乙烷与NaOH乙醇溶液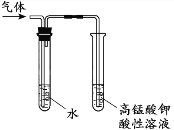
D. 制取并提纯乙酸乙酯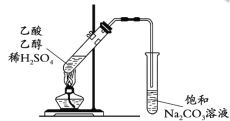
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下列实验现象的解释,不合理的是
实验 | 现象 | 解释 | |
A | | ②中产生气体的速率比①慢 | 乙醇分子中,乙基对羟基产生影响,使O—H键不容易断裂 |
B |
| ③中振荡静置后分层,上层为橙色;④中产生白色沉淀 | 苯酚分子中,苯环对羟基产生影响,使O—H键更容易被取代 |
C |
| ⑤中振荡静置后分层,下层为紫色溶液;⑥中振荡后紫色溶液褪色 | 甲苯分子中,苯环对甲基产生影响,使甲基上C—H更容易被氧化 |
D |
| 水浴加热,⑦中未见明显变化;⑧中试管壁上附着一层光亮的银 | 碱性条件下+1价的Ag才能氧化乙醛 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2通人BaCl2溶液至饱和的过程中,始终未观察到溶液中出现浑浊,若再通入另种气体A,则产生白色沉淀。制备气体A的试剂不可能是( )
A.Cu和浓硝酸
B.NaOH和浓氨水
C.大理石和稀盐酸
D.MnO2和浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中,对于可逆反应A(g)+B(g)![]() 2C(g),可以判断达到化学平衡状态的是( )
2C(g),可以判断达到化学平衡状态的是( )
A. 体系压强不变 B. 单位时间消耗n molA,同时生成2nmolC
C. A的转化率不变 D. 容器内气体密度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
(1)SCR(选择性催化还原)工作原理:
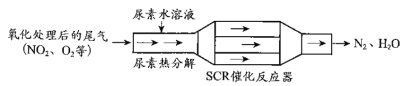
① 尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式:____________。
② 反应器中NH3还原NO2的化学方程式:____________。
③ 当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒。用化学方程式表示(NH4)2SO4的形成:________。
④ 尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60 g·mol 1)含量的方法如下:取a g尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1 mL c1 mol·L1 H2SO4溶液吸收完全,剩余H2SO4用v2 mL c2 mol·L1 NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是________。
(2)NSR(NOx储存还原)工作原理:
NOx的储存和还原在不同时段交替进行,如图a所示。
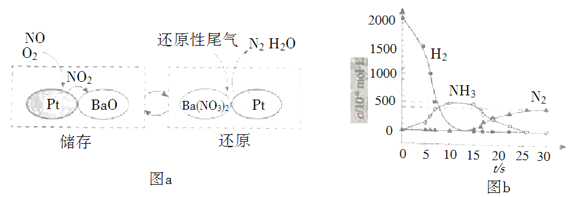
① 通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。储存NOx的物质是_________。
② 用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的H2与Ba(NO3)2的物质的量之比是__________。
③ 还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整: _______![]() □15NNO+□H2O_______
□15NNO+□H2O_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA为阿伏加德罗常数的值,下列说法正确的是
A. 3gCO2中含有的质子数为1.5NA
B. 1L0.1mol·L-1 Na2SiO3溶液中含有的SiO32-数目为0.1NA
C. 0.1molH2O2分解产生O2时,转移的电子数为0.2NA
D. 2.8g聚乙烯中含有的碳碳双键数目为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com