
【题目】[化学——选修3:物质结构与性质]某绿色农药结构简式为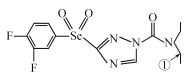 ,回答下列问题。
,回答下列问题。
(1)N元素的基态原子核外有_____种空间运动状态的电子,该农药组成元素中,第一电离能较大的前三种元素是(按由大到小顺序排列)__________________(用元素符号回答,下同),基态硒原子的价层电子排布式为________________________。
(2)该物质中杂化轨道类型为sp2的原子有__________,分子内,分子中编号为①的碳原子和与其成键另外几个原子构成的空间结构为_____________。
(3)碳、氢、氧元素可形成一系列的化合物,如CH4、C2H6、CH3OH等。三种物质的沸点高低顺序为CH4<C2H6<CH3OH,其原因是_______________________________________,三种物质中属于极性分子的物质是__________,与CH4互为等电子体的一种微粒是______。
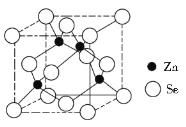
(4)硒化锌的晶胞结构如图所示,则硒的配位数为_______,若晶胞边长为d pm,设阿伏加德罗常数的值为NA,则硒化锌的密度为____________(不必化简)。
【答案】(1)5(1分) F>N>O (2分) 4s24p4(1分)
(2)N、C (2分) 四面体(2分)
(3)乙烷的分子间力比甲烷的大,甲醇可形成分子间氢键而乙烷不能(2分) CH3OH(1分) ![]() (1分)
(1分)
(4)4(1分) ![]() g/cm3(2分)
g/cm3(2分)
【解析】(1)基态氮原子的电子占据5个原子轨道,故有5种不同空间运动状态的电子。由周期表中第一电离能递变规律及N原子的3p能层电子处于半充满状态知,第一电离能较大的前三种元素分别是F、N、O。
(2) 由结构简式知,分子中有形成3个σ键、1个π键的碳原子、有形成2个σ键、1个π键还有一个孤电子对的氮原子,故杂化轨道类型为sp2的有氮原子,碳原子。①号碳原子形成了四个σ键,故为四面体结构。
(3)三种物质均是分子晶体,乙烷相对分子质量比CH4的大,分子间作用力比甲烷的大。乙烷与甲醇相对分子质量相差很小,甲醇可形成分子间氢键而乙烷不能,故甲醇沸点高于乙烷。甲烷和乙烷属于非极性分子,甲醇属于极性分子。与CH4互为等电子体的一种微粒为![]() 。
。
(4)观察硒化锌的晶胞结构知,硒、锌原子的配位数均是4个。一个晶胞中含有4个“ZnSe”结构单元,其质量m=![]() ×144=
×144=![]() g,晶胞的体积为(d×10-10 cm)3,密度为
g,晶胞的体积为(d×10-10 cm)3,密度为![]() g/cm3。
g/cm3。


科目:高中化学 来源: 题型:
【题目】固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆—氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如下图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是

A. 有O2放电的a极为电池的负极
B. O2-移向电池的正极
C. b极对应的电极反应为2H2-4e-+2O2-=2H2O
D. a极对应的电极反应为O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己二酸 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如下:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如下:
![]()

可能用到的有关数据如下:
物质 | 密度(20℃) | 熔点 | 沸点 | 溶解性 | 相对分子质量 |
环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度3.6g,可混溶于乙醇、苯 | 100 |
乙二酸 | 1.36g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时,1.44g,25℃时2.3g,易溶于乙醇,不溶于苯 | 146 |
实验步骤如下:
I、在三口烧瓶中加入16mL50%的硝酸(密度为1.31g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4mL环己醇。
Ⅱ、水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间。
Ⅲ、当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止。
IV、趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品。
V、粗产品经提纯后称重为5.7g。
请回答下列问题:
(1)滴液漏斗的细支管a的作用是_____________,仪器b的名称为_____________。
(2)已知用NaOH溶液吸收尾气时发生的相关反应方程式为:
2NO2+2NaOH═NaNO2+NaNO3+H2O,NO+NO2+2NaOH═2NaNO2+H2O;如果改用纯碱溶液吸收尾气时也能发生类似反应,则相关反应方程式为:_____________、_____________。
(3)向三口烧瓶中滴加环己醇时,要控制好环己醇的滴入速率,防止反应过于剧烈导致温度迅速上升,否则。可能造成较严重的后果,试列举一条可能产生的后果:_____________。
(4)为了除去可能的杂质和减少产品损失,可分别用冰水和_____________洗涤晶体。
(5)粗产品可用_____________法提纯(填实验操作名称).本实验所得到的己二酸产率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修5有机化学基础】有机物H是一种具有很强的亲水性高分子化合物。其合成路线如下:
![]()

已知:
①R—CHO+![]()
![]()

![]()
![]() ;
;
②![]()
![]()
![]() ;
;
③B的核磁共振氢谱有两个峰,且峰面积之比为1∶2。
请回答下列问题:
(1)A的名称是____________;B的官能团名称是______________________;
D的结构简式是____________________。
(2)反应⑤的反应类型是__________。
(3)反应④的化学方程式为______________________________。
(4)C的同分异构体中含有![]() 的有_________种。其中能与NaHCO3反应产生气体的同分异构体的结构简式是_________________________________。
的有_________种。其中能与NaHCO3反应产生气体的同分异构体的结构简式是_________________________________。
(5)根据已有知识并结合相关信息,仿上述流程,有机物以结构简式来表示,写出以甲苯和乙醛为原料制备肉桂醛( )的合成路线流程图(无机试剂任用):
)的合成路线流程图(无机试剂任用):
______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的物质变化、能量变化、速率变化及反应的限度均是化学工作者研究的内容。
(1)对于基元反应(即反应物一步转化为生成物的反应)mA+nB![]() pC+qQ来说,其反应速率v=k正cm(A)cn(B)(可逆反应也存在类似的表达式),k为只与温度有关的速率常数;对于非基元反应(即不是一步完成的反应),则速率公式中的m、n就不一定均等于A、B的化学计量数,若某一物质对反应速率无影响,则其不会出现在上述公式中。
pC+qQ来说,其反应速率v=k正cm(A)cn(B)(可逆反应也存在类似的表达式),k为只与温度有关的速率常数;对于非基元反应(即不是一步完成的反应),则速率公式中的m、n就不一定均等于A、B的化学计量数,若某一物质对反应速率无影响,则其不会出现在上述公式中。
某科研小组测量反应“H2O2+2I+2H+![]() I2+H2O”的部分实验数据如下表所示
I2+H2O”的部分实验数据如下表所示
c(H2O2)/(mol·L1) | c(I)/(mol·L1) | c(H+)/(mol·L1) | I2的生成速率(mol·L1·s1) |
0.010 | 0.010 | 0.010 | 1.75 |
0.030 | 0.010 | 0.10 | 5.25 |
0.030 | 0.020 | 0.10 | 1.05 |
0.030 | 0.020 | 0.20 | 1.05 |
该反应的反应速率与浓度关系表达式为_________________,速率常数k=____________,该反应_______(填“是”或“不是”)基元反应。
(2)氮的氧化物是造成大气污染的主要成分之一,有多种方法消除氮氧化物的污染。下列 反应是消除污染的方法之一。
反应Ⅰ:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH =746 kJ·mol1
N2(g)+2CO2(g) ΔH =746 kJ·mol1
反应Ⅱ:CO(g)+NO2(g)![]() CO2(g)+ NO(g) ΔH=227 kJ·mol1
CO2(g)+ NO(g) ΔH=227 kJ·mol1
①写出CO将NO2还原为单质的热化学方程式 。
②已知C≡O的键能为1076 kJ·mol1、C=O的键能为745 kJ·mol1,则使1 mol NO2(g)、1 mol NO(g)分解成相应的原子所需要的能量之差是___________。
(3)向某密闭容器中通入等物质的量的CO、NO,在一定条件下发生如下反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH =746 kJ·mol1。测得反应在不同温度、压强条件下,平衡混合物中CO2的体积分数如图1所示。又知该反应的逆反应速率公式为v逆=
N2(g)+2CO2(g) ΔH =746 kJ·mol1。测得反应在不同温度、压强条件下,平衡混合物中CO2的体积分数如图1所示。又知该反应的逆反应速率公式为v逆=
k逆c2(CO2)·c(N2),实验测得平衡时v逆与c(N2)的关系如图2所示。
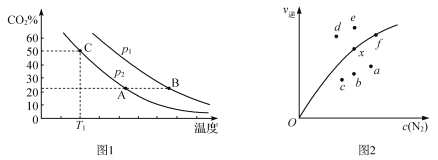
①图Ⅰ中,A、B两点对应的平衡常数K(A)_________K(B)(填“>”、“<”或“=”,下同),p1_______p2,C点所对应的反应中N2的产率是_______________。
②图Ⅱ中,当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从废电池外壳中回收锌(锌皮中常有少量铁、外表沾有NH4Cl、ZnCl2、MnO2等杂质),制取ZnSO4·7H2O可以采取如下工艺流程:

金属氢氧化物沉淀的pH:
氢氧化物 | 开始沉淀的pH | 完全沉淀的pH |
Zn(OH)2 | 5.7 | 8.0 |
Fe(OH)3 | 2.7 | 3.7 |
![]() 回答下列问题:
回答下列问题:
(1)酸溶时常常加入少量的CuSO4,其目的是 。
(2)写出氧化时的离子方程式 。该过程中加入的H2O2量要远多于理论值,原因除了提高另外反应物的转化率外,还可能是 。
(3)调节pH大于8后会造成锌元素转化率降低,其原因是 。
(4)从滤液B获得Na2SO4应该采用的方法是蒸发结晶, ,洗涤干燥。(部分物质的溶解度曲线见下图)

(5)由滤渣B制备ZnSO4·7H2O的实验方案为:_ __ __,干燥得到ZnSO4·7H2O (实验中须使用的试剂有:1mol/LH2SO4,蒸馏水,乙醇;除常用仪器外须使用的仪器有:pH计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料是人类生存和社会进步的物质基础。
(1)铁是是现代化学工业的基础,人类进步必不可少的金属材料。工业上冶炼铁是在炼铁高炉内用一氧化碳将氧化铁还原为金属铁。已知:
① 2Fe(s)+ ![]() O2(g)=Fe2O3(s) △H=-824.6kJ/mol
O2(g)=Fe2O3(s) △H=-824.6kJ/mol
② CO(g)+![]() O2(g)= CO2(g) △H=-283.0kJ/mol
O2(g)= CO2(g) △H=-283.0kJ/mol
请写出炼铁高炉中冶铁的热化学方程式 。
(2)下图表示一定温度下,贮氢合金(M)的贮氢过程,纵轴为平衡时氢气的压强(p),横轴表示固相中氢原子与金属原子个数比(H/M)。当反应处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,达到平衡后反应可能处于图中的_____点(填“b”“c”或“d”)。10g该合金2min内吸收氢气500mL,吸氢速率v=______mLg-1min-1。

(3)氮化硅是一种耐高温陶瓷材料。可用四氯化硅和氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅,反应的化学方程式为________。
(4)高氯酸铵(NH4ClO4)是用于导弹和火箭发射推进剂的新材料。传统制备NH4ClO4的方法是电解NaClO3水溶液得到NaClO4,再与NH4Cl进行复分解反应,经重结晶得到粗产品后,经多步精制、提纯得到高纯NH4ClO4。新近研究了一种制备高纯NH4ClO4的新工艺,其基本方法是用惰性电极电解高纯HClO得到高纯HClO4,再与高纯氨NH3进行喷雾反应制成高氯酸铵。
请回答下列问题:
①写出由次氯酸电解制备高氯酸的阳极电极反应式: 。
②与传统工艺相比,你认为新工艺有哪些优点: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常见有机物转化关系(部分相关物质和反应条件已略去)
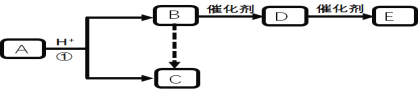
已知:Ⅰ. C的相对分子质量为60,且分子中碳元素的质量分数为40% 。
Ⅱ.B、 C、D分子含碳原子个数相同;E为高分子化合物。
回答下列问题:
(1)B中含有的官能团名称为 。
(2)E中链节为 。
(3)写出反应①的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二十一世纪钛将成为铁、铝之后的第三大金属,工业上以钛铁矿为原料制备二氧化钛及钛的工艺流程如下图所示,钛铁矿的主要成分为钛酸亚铁(FeTiO3),其中一部分铁元素在风化过程中会转化为+3价,FeTiO3溶于酸后Ti元素以TiO2+存在,TiOSO4遇水可水解。
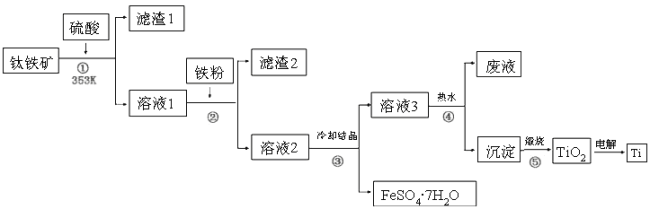
请根据以上信息回答下列问题:
(1)②中加入铁粉的目的是__________;
(2)③中混合物分离的依据是________(填字母序号)。
a.熔、沸点差异 b.溶解性差异 c.氧化性、还原性差异
(3)②、③、④中均需要进行的操作是________(填操作名称)。
(4)写出④的离子方程式:_______________;该过程在热水中操作的目的是_________
(5)利用生产过程中的废液与软锰矿(主要成分为MnO2)反应可生产硫酸锰(MnSO4,易溶于水),该反应的离子方程式为_______________。
(6)科学家从电解冶炼铝的工艺得到启发.找出了冶炼钛的新工艺。
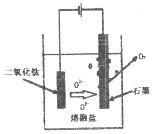
①直接电解固体TiO2法生产钛,原理如图所示,则阴极获得钛的电极反应为_____________。
②电解一段时间后,需要更换石墨电极,原因是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com