
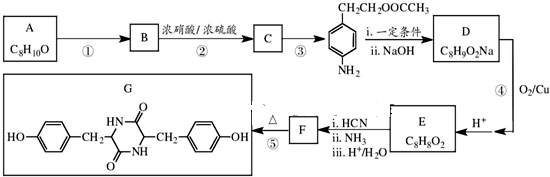
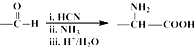 ,NO2$\stackrel{Fe?HCl}{→}$NH2
,NO2$\stackrel{Fe?HCl}{→}$NH2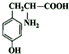 .
. .
. .
.分析 根据流程图中转化关系,由第③步生成的物质结构中含有酯基,氨基,说明第③步发生硝基还原为氨基的反应,第②步是硝化反应,则C为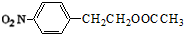 ,结合A的分子式可知,反应①反应为酯化反应,则B为
,结合A的分子式可知,反应①反应为酯化反应,则B为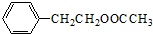 ,A为
,A为 .由G的结构简式,逆推可知F为
.由G的结构简式,逆推可知F为 ,结合E的分子式与反应信息可知,E为
,结合E的分子式与反应信息可知,E为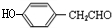 ,D发生催化氧化,酸化得到E,结合E的结构与反应③的结构可知,D为
,D发生催化氧化,酸化得到E,结合E的结构与反应③的结构可知,D为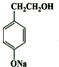 ,据此解答.
,据此解答.
解答 解:根据流程图中转化关系,由第③步生成的物质结构中含有酯基,氨基,说明第③步发生硝基还原为氨基的反应,第②步是硝化反应,则C为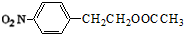 ,结合A的分子式可知,反应①反应为酯化反应,则B为
,结合A的分子式可知,反应①反应为酯化反应,则B为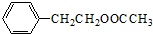 ,A为
,A为 .由G的结构简式,逆推可知F为
.由G的结构简式,逆推可知F为 ,结合E的分子式与反应信息可知,E为
,结合E的分子式与反应信息可知,E为 ,D发生催化氧化,酸化得到E,结合E的结构与反应③的结构可知,D为
,D发生催化氧化,酸化得到E,结合E的结构与反应③的结构可知,D为 .
.
(1)由G的结构简式可知,所含的官能团的名称是酰胺键和羟基,则B为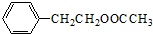 ,分子中含有6种氢原子,核磁共振氢谱有6个吸收峰,
,分子中含有6种氢原子,核磁共振氢谱有6个吸收峰,
故答案为:羟基;6;
(2)由上述分析可知,反应①为酯化反应,属于取代反应,第③步发生硝基还原为氨基的反应,属于还原反应,
故答案为:取代反应;还原反应;
(3)由上述分析可知,A的结构简式为 ,名称为苯乙醇,F的结构简式为
,名称为苯乙醇,F的结构简式为 ,
,
故答案为:苯乙醇; ;
;
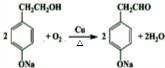
(4)反应④的化学方程式为: ,
,
故答案为: ;
;
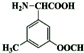
(5)C(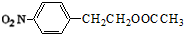 )有多种同分异构体,同时满足下列条件的同分异构体:(Ⅰ)属于α-氨基酸,且苯环上有三个互为间位的取代基,
)有多种同分异构体,同时满足下列条件的同分异构体:(Ⅰ)属于α-氨基酸,且苯环上有三个互为间位的取代基,
(Ⅱ)与FeCl3溶液作用无显色现象,说明没有酚羟基,
(Ⅲ)1mol该同分异构体与足量NaOH溶液反应时消耗3mol NaOH,还含有羧酸与酚形成的酯基,结合C的分子式可知,符合条件的同分异构体为 ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成,充分利用G的结构与反应③的产物结构进行推断,需要学生熟练掌握官能团的性质与转化,既注重基础知识巩固训练,又较好的考查学生分析推理能力与知识迁移应用,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 编号 | 金属(块状) | 酸的浓度及体积 | 反应温度(℃) |
| A | Mg0.1mol | 6mol/L硝酸10mL | 70 |
| B | Mg0.2mol | 3mol/L盐酸40mL | 60 |
| C | Fe0.2mol | 3mol/L盐酸50mL | 60 |
| D | Mg0.1mol | 3mol/L硫酸10mL | 60 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
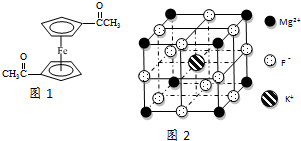
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 3种 | C. | 2种 | D. | 1种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | c(HA)/mol•L-1 | c(NaOH)/mol•L-1 | 混合后溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | b | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH<7 |
| 丁 | 0.1 | 0.1 | pH=c |
| A. | 甲中:若a=7,则HA是强酸 | |
| B. | 乙中:若b≠0.2,则c(A-)≠c(Na+) | |
| C. | 丙中:若HA是弱酸,则c(A-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 丁中:若c=9,则c(OH-)-c(HA)=10-9mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D四种元素,A元素的原子的所有能级具有相同的电子数,由B元素形成的单质在常温常压为易挥发的液体,可从海水是提取,C及其合金是人类最早使用的金属材料.D与A位于同一主族,是构成地球上矿物质的主要元素.请回答下列问题:
有A、B、C、D四种元素,A元素的原子的所有能级具有相同的电子数,由B元素形成的单质在常温常压为易挥发的液体,可从海水是提取,C及其合金是人类最早使用的金属材料.D与A位于同一主族,是构成地球上矿物质的主要元素.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
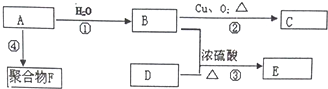
 .
.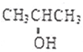 化学性质与B相似,试写出
化学性质与B相似,试写出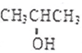 在有催化剂和加热条件下与O2反应的化学方程式:2
在有催化剂和加热条件下与O2反应的化学方程式:2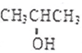 +O2$→_{△}^{催化剂}$2CH3COCH3+2H2O.
+O2$→_{△}^{催化剂}$2CH3COCH3+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某中学化学实验小组为了证明和比较SO2与氯水的漂白性,设计了如下装置:
某中学化学实验小组为了证明和比较SO2与氯水的漂白性,设计了如下装置:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 数目为NA的一氧化碳分子和0.5 mol甲烷的质量比为7:4 | |
| B. | 标准状况下,22.4 L水中含有水分子的数目为NA | |
| C. | 14 g N2中含有电子的数目为14NA | |
| D. | 2.3g Na完全反应时,转移电子的数目为0.1 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com