
【题目】常温下,体积都为V0mL、浓度都为0.1mol·L-1的MC1、NaR、MR三种盐溶液,加入蒸馏水稀释至VmL,溶液的pH与1g(V/V0)的关系如图所示。下列说法不正确的是

A. 曲线X代表NaR溶液,其中c(OH-)=c(H+)+c(HR)
B. 曲线Y中任何两点,水的电离程度都相同
C. 将等体积等物质的量浓度的MC1和NaR溶液混合后,c(M+)=c(R-)
D. 常温下,HR的电离常数Ka≈1×10-5
【答案】B
【解析】
从图分析,三种盐分别酸性、碱性和中性,所以MOH为弱碱、HR为弱酸,则MC1为强酸弱碱盐,NaR为强碱弱酸盐,MR为弱酸弱碱盐。即X为NaR,Y为MR,Z为MC1。
A. 曲线X代表NaR溶液,为强碱弱酸盐,其中存在质子守恒,c(OH-)=c(H+)+c(HR),故正确;
B. 曲线Y为MR,弱酸弱碱盐,溶液呈中性,说明弱酸根离子和弱碱的阳离子水解程度相同,但促进水电离,向溶液中加水稀释,水解程度增大,即水的电离程度增加,故错误;
C. 将等体积等物质的量浓度的MC1和NaR溶液混合后M+、R-的水解程度相同,则有c(M+)=c(R-)。故正确;
D. 0.1mol·L-1NaR的pH=9,水解平衡常数约为![]() ,根据电离平衡常数和水解平衡常数的关系KW=Ka×Kh分析,常温下,HR的电离常数Ka≈1×10-5,故正确。
,根据电离平衡常数和水解平衡常数的关系KW=Ka×Kh分析,常温下,HR的电离常数Ka≈1×10-5,故正确。
故选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,用0.10 mol·L-1盐酸分别滴定20.00 mL浓度均为0.10 mol·L-1 CH3COONa溶液和NaCN溶液,所得滴定曲线如右图(忽略体积变化)。下列说法正确的是

A. 溶液中阳离子的物质的量浓度之和:点②等于点③
B. 点①所示溶液中:c(CN—)+ c(HCN)=2c(Cl—)
C. 点②所示溶液中:c(Na+)> c(Cl-)> c(CH3COO-)> c(CH3COOH)
D. 点④所示溶液中:c(Na+)+ c(CH3COOH)+ c(H+)>0.10 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚丙烯是日常生活中用途非常广泛的一种塑料,下列说法不正确的是
A. 单体是:CH3-CH=CH2
B. 链节是:-CH3-CH-CH2-
C. 平均相对分子质量=42×n(n为聚合度)
D. 是一种难降解的塑料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知过氧化氢在强碱性溶液中主要以HO2-存在。我国研究的Al-H2O2燃料电池可用于深海资源的勘查、军事侦察等国防科技领域,装置示意图如下。下列说法错误的是
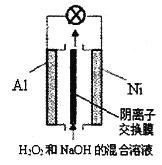
A. 电池工作时,溶液中OH-通过阴离子交换膜向Al极迁移
B. Ni极的电极反应式是HO2-+2e-+H2O=3OH-
C. 电池工作结束后,电解质溶液的pH降低
D. Al电极质量减轻13.5g,电路中通过9.03×1023个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成:
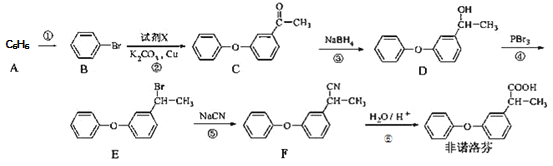
回答下列问题
(1)![]() 的化学名称是_____________,
的化学名称是_____________,![]() 中含氧官能团的名称为___________。
中含氧官能团的名称为___________。
(2)上述反应中,反应①的条件是___________,过程①属于______反应
(3)反应②发生的是取代反应,且另一种产物有![]() ,写出由
,写出由![]() 生成
生成![]() 的化学方程式______。
的化学方程式______。
(4)有机物![]() 与非诺芬互为同分异构体,
与非诺芬互为同分异构体,![]() 满足下列条件:
满足下列条件:
I.能与NaHCO3溶液反应,且能与FeCl3溶液发生显色反应
II.分子中有6种不同化学环境的氢,且分子中含有两个苯环
![]() 的结构有_____种,写出其中一种不能与浓溴水发生取代反应的
的结构有_____种,写出其中一种不能与浓溴水发生取代反应的![]() 的结构简式_________。
的结构简式_________。
(5)根据已有知识并结合相关信息,写出以![]() 为原料制备
为原料制备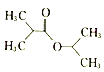 路线流程图(无机试剂任用)_________
路线流程图(无机试剂任用)_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的综合利用对促进“低碳经济”的发展有重要意义。
(1)工业上以CO2、NH3为原料生产尿素[CO(NH2)2],反应实际为两步进行:
I:2NH3(g)+CO2(g)![]() H2NCOONH4(s) △H1=-272kJ·mol-1
H2NCOONH4(s) △H1=-272kJ·mol-1
II:H2NCOONH4(s)![]() CO(NH2)2(s)+H2O(g) △H2=+138kJ·mol-1
CO(NH2)2(s)+H2O(g) △H2=+138kJ·mol-1
已知:H2O(l)==H2O(g) △H3=+44kJ·mol-1
①请写出以NH3、CO2为原料,合成尿素和液态水的热化学方程式______________。
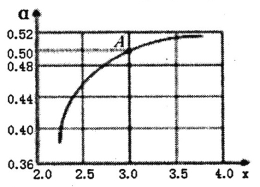
②T1℃时,在1L的密闭容器中充入CO2和NH3模拟工业生产,n(NH3)/n(CO2)=x,如图是CO2平衡转化率(![]() )与x的关系。求图中A点NH3的平衡转化率
)与x的关系。求图中A点NH3的平衡转化率![]() =________%。
=________%。
③当x=1.0时,若起始的压强为p0kPa,水为液态,平衡时压强变为起始的1/2。则该反应的平衡常数Kp=_______(kPa)-3(KP为以分压表示的平衡常数)。
(2)用CO2和H2合成甲醇:3H2(g)+CO2(g)![]() CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。在T℃时,甲、乙、丙三个2L的恒容密闭容器中,按不同方式投入反应物,测得平衡时有关数据如下:
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。在T℃时,甲、乙、丙三个2L的恒容密闭容器中,按不同方式投入反应物,测得平衡时有关数据如下:
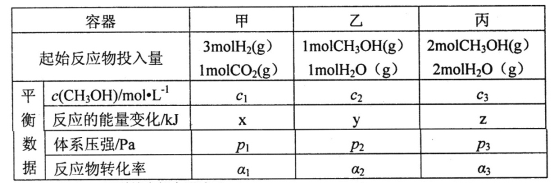
①甲容器10s达到平衡时测得x=39.2,则甲中CO2的平均反应速率____________。
②下列说法正确的是________(填字母编号)。
A.2c1<c3 B.z<2y C.p3>2p2 D.α1+α3>1
(3)用NaOH溶液做碳捕捉剂可获得化工产品Na2CO3。常温下若某次捕捉后得到pH=10的溶液,则溶液中c(CO32-):c(HCO3-)=_____[K1(H2CO3)=4.4×10-7、K2(H2CO3)=5×10-11],溶液中c(Na+)_____c(HCO3-)+2c(CO32-)(填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ba(OH)2是一种强碱,可用于测定天然气中CO2的含量。
(1)请写出足量氢氧化钡溶液吸收CO2气体的离子方程式:__________。
(2)某课外小组通过以下实验操作测定Ba(OH)2·nH2O中n的值。
①称取5.25g试样(含有杂质)配成100mL溶液。配置溶液中用到的仪器有天平、__________、__________、__________和胶头滴管。若配制过程中定容后经振荡、摇匀、静置,发现液面下降,再加适量蒸馏水,则所得溶液的浓度将__________(填“偏大”、“不变”或“偏小”)。
②用30.00mL 1mol·L-1盐酸与上述Ba(OH)2溶液反应,消耗该Ba(OH)2溶液100.00mL(杂质不与酸反应),则该Ba(OH)2溶液的物质的量浓度为__________。
③另取5.25g试样加热至失去全部结晶水(杂质不分解),称得剩余固体质量为3.09g,则Ba(OH)2·nH2O中n=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾中含有多种污染物,其中有氮氧化物(NOx)、CO、SO2等,给人类健康带来了严重影响,化学在解决雾霾污染中发挥了重要作用。
(1)煤燃烧产生的烟气中含有氮的氧化物,用CH4催化还原消除污染。请写出CH4与NO2反应的化学方程式_____________。
(2)汽车尾气中CO、NO2气体在一定条件下可以发生反应:
2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-746.8kJ·mol-1
N2(g)+2CO2(g) △H=-746.8kJ·mol-1
4CO(g)+2NO2(g)![]() 3CO2(g)+N2(g) △H=-1200kJ·mol-1
3CO2(g)+N2(g) △H=-1200kJ·mol-1
则反应的CO(g)+NO2(g)![]() CO2(g)+NO(g) △H=_____kJ·mol-1
CO2(g)+NO(g) △H=_____kJ·mol-1
(3)氮硫的氧化物间存在如下转化SO2(g)+NO2(g)![]() SO3(g)+NO(g);实验测得平衡常数 与温度的关系如下图所示。回答下列问题:
SO3(g)+NO(g);实验测得平衡常数 与温度的关系如下图所示。回答下列问题:

①该反应正反应的活化能___(填“>”或“<”)逆反应的活化能。
②反应速率v=V正-V逆=k正xSO2·xNO2-k逆xSO3·xNO,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,T℃时,k正_____k逆(填“>”、“<”或“=”)。
③T℃时,在体积为2L的容器中加入1molSO2(g)、1molNO2(g),5min时测得xSO3=0.2,此时平衡向___(填“正”或“逆”)反应方向移动,![]() =___(保留2位小数)。
=___(保留2位小数)。
(4)已知:2NO(g)=N2(g)+O2(g) ΔH=-180.6kJ/mol,在某表面催化剂的作用下,NO可以分解生成N2、O2,其反应机理可简化为:
第一步:2NO →N2O2 快
第二步:N2O2 →N2+O2 慢
下列表述正确的是____(填标号)。
A.所有化合反应都是放热反应
B.N2O2是该反应的的中间产物
C.加入合适的催化剂可以减小反应热ΔH,加快反应速率
D.第一步的活化能比第二步低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1表示甲,乙两种无机盐离子处于不同浓度时与作物产量的关系;图2表示不同浓度钙对某植物花粉萌发和花粉管生长的影响。下列描述正确的是

A.同种作物对甲、乙两种离子的需求量相同
B.从生产实际考虑,c、d浓度相比,要想提高产量,d浓度为最佳
C.适宜浓度的钙有利于花粉管的生长
D.在一定范围内,钙的浓度对花粉萌发率有影响
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com